Что внутри аккумулятора телефона (литий-ионной батареи
При недавнем добавлении новых разделов сайта нашего интернет-магазина Neovolt.ru, посвящённых замене элементов питания на нашем производственном предприятии, появилась идея сделать простые схемы устройства аккумуляторов для иллюстрирования материалов.
Несложная с виду идея вылилась в многочасовую проверку возможных изобретений новых вариантов конструкций, в перелопачивание тонны публикаций на BatteryUniversity, в общение с экспертами и инженерами на Quora и в Reddit по материалам в сепараторах и проводниках, чтобы ничего не упустить из внимания.
Получился огромный материал, который в дальнейшем пришлось сократить, иначе можно книгу написать. Результатом делимся с вами.
→ О принципах выбора ёмкости, определения ремонтопригодности, формы и размеров аккумулятора смартфона — в исследовании Карстена Шишке.
Батареи литий-ионного или литий-полимерного типа работают с помощью химических реакций, которые «отправляют» электроны и ионы с одного электрода на другой. Вот, как всё выглядит, когда наш инженер разбирает внешнюю часть корпуса аккумулятора, например, Samsung Galaxy S9 или любого другого смартфона после извлечения из устройства.
Вот, как всё выглядит, когда наш инженер разбирает внешнюю часть корпуса аккумулятора, например, Samsung Galaxy S9 или любого другого смартфона после извлечения из устройства.
Устройство аккумулятора телефона/смартфона:
(1) Соединительный элемент подключает аккумулятор к системной плате смартфона (в несъёмной конструкции) или к контактам на внешнем корпусе батареи (в съёмной конструкции).
- • Он может быть в виде многожильного провода (как на схеме) или в виде шлейфа.
- • Шлейф имеет гибкую (как у iPhone 6) или формованную (как у Galaxy S8 Plus) основу.
- • У соединительного кабеля чаще всего есть коннектор с несколькими контактами (от двух до пяти).
- • В редких старых или бюджетных смартфонах соединение с системной платой выполняется не через разъём, а методом пайки (у нас есть пример такого соединения в инструкции разборки iPod Touch 6).
(2) — Плата системы управления аккумулятором (Battery Management System, BMS). На неё устанавливается логика работы батареи и предохранитель.
На неё устанавливается логика работы батареи и предохранитель.
→ Узнайте, как устроена BMS-плата и все подробности по её функциональной роли в телефоне.
(3) и (4) — Положительный и отрицательные выводы питания для работы в электрической цепи.
(5) и (7) — Электродные материалы размещаются на тонкой металлической основе, напоминающей фольгу. Она собирает электроны и передаёт их из батареи к устройству.
Электроды не способны хранить много энергии в ограниченной зоне.
Поэтому нужны длинные скрутки таких полос, чтобы аккумулятор смог обеспечить смартфон необходимой энергией. Их количество и размеры влияют на конечную ёмкость и габариты батареи. Кстати, мы уже рассказывали, по какому принципу производители выбирают и проектируют аккумулятор в процессе разработки очередного смартфона.
(6) и (8) — Сепаратор препятствует электрической проводимости между электродными материалами (катодом и анодом) в пределах тока, который должен проходить через сепаратор в процессе движения ионов от катода к аноду (во время заряда) и обратно (во время разряда).
С превышением температуры (выше 130°C) материал плавится и закрывает поры во избежания дальнейшей катализации химической реакции и взрыва аккумулятора.
В большинстве смартфонов сепаратор однослойный из полиэтиленового материала, пропитанного электролитом.
Хотя последнее время в применение вошли сепараторы трёхслойной «гамбургерной» конструкции для более надёжной работы аккумулятора в условиях повышенной нагрузки:
- • Полипропилен (стойкость +155°C)
- • Полиэтилен (стойкость +130°C)
- • Полипропилен (стойкость +155°C)
(9) — Корпус аккумулятора представляет собой термостойкий материал с достаточной прочностью, чтобы выдерживать небольшие физические воздействия (например, от стягивания внутренних комплектующих смартфона).
В съёмной конструкции размещается в ударостойкую оболочку с контактной площадкой.
Это нужно для удобного и, главное, безопасного хранения вне мобильного устройства (из-за чего превышает габариты несъёмного аккумулятора аналогичных технических характеристик). Может иметь разные виды материалов, выбор которых зависит от производителя.
Может иметь разные виды материалов, выбор которых зависит от производителя.
Научно-популярные статьи
Вы помогаете наполнять базу знаний Neovolt без ошибок и упущений. Пишите в комментарии предложения, свои взгляды и замечания — мы их читаем все без исключения. Или отправьте сообщение нам ВКонтакте @NeovoltRu.
Подпишитесь в группе на новости из мира гаджетов, узнайте об улучшении их автономности и прогрессе в научных исследованиях аккумуляторов. Подключайтесь к нам в Facebook и Twitter. Мы также ведём насыщенный блог в «Дзене» и на Medium — заходите посмотреть.
Теги: База знаний Li-Ion Li-Poly Телефоны Смартфоны Планшеты Ноутбуки Технологии
Материалы, используемые в аккумуляторах (батареях)
- Категория: Поддержка по аккумуляторным батареям
- Опубликовано 22.04.2016 01:45
- Автор: Abramova Olesya
- 1.
 Алюминий
Алюминий - 2. Ванадий
- 3. Железо
- 4. Кадмий
- 5. Кальций
- 6. Марганец
- 7. Натрий
В электрических батареях используются разнообразные химические элементы, добываемые из земной коры. Забавно то, что ровно такие же элементы входят в состав всех живых существ на нашей планете. Как и в живом организме, вещества для электрических батарей должны быть тщательно подобраны в нужном количестве, чтобы достичь гармоничного взаимодействия. Превышение количества всего лишь одного материала может испортить весь тонкий баланс.
Аккумуляторы EverExceed
| Standard Range AGM | Deep Cycle Range AGM | Gellyte Range GEL |
| 10 — 12 лет / 600 циклов | 10 — 12 лет / 700 циклов | 10 — 12 лет / 750 циклов |
| универсальная серия AGM | для глубоких разрядов AGM | универсальная серия GEL |
Алюминий (Al) представляет собой мягкий, серебристо-белый, немагнитный металл. Добытый из бокситов, он является третьим наиболее распространенным элементом в земной коре после кислорода и кремния. При контакте с воздухом алюминий образует пассивирующий слой, который защищает металл от коррозии. Алюминий используется в качестве материала катода в некоторых версиях литий-ионных аккумуляторов
Добытый из бокситов, он является третьим наиболее распространенным элементом в земной коре после кислорода и кремния. При контакте с воздухом алюминий образует пассивирующий слой, который защищает металл от коррозии. Алюминий используется в качестве материала катода в некоторых версиях литий-ионных аккумуляторов
Ванадий (V) является очень твердым металлом серебристого цвета. Он был обнаружен в 1801 году в Мексике, находится в составе 65 минералов и образует устойчивый слой оксида на своей поверхности. Крупнейшими производителями ванадия являются Китай и Россия. Этот металл используется в специальных сплавах, а в сфере электрохимических источников энергии он востребован в проточной [BU-210b] конструкции аккумуляторов.
Железо – это наиболее распространенный по массе элемент на нашей планете. Химическое обозначение Fe происходит от латинского слова “ferrum”. Железо использовалось человечеством еще с незапамятных времен, хотя медные сплавы с более низкой температурой плавления существовали еще раньше. Чистое железо является достаточно мягким, и может быть укреплено с помощью создания сплава с углеродом. Соединения железа играют важную роль в биологии. В сфере электрических батарей железо нашло свое применение в литий-железо-фосфат-оксидной [BU-205] электрохимической системе.
Железо использовалось человечеством еще с незапамятных времен, хотя медные сплавы с более низкой температурой плавления существовали еще раньше. Чистое железо является достаточно мягким, и может быть укреплено с помощью создания сплава с углеродом. Соединения железа играют важную роль в биологии. В сфере электрических батарей железо нашло свое применение в литий-железо-фосфат-оксидной [BU-205] электрохимической системе.
Аккумуляторы EverExceed GEL
| Marin GEL Range | Deep Cycle GEL Range | Solar GEL Range |
| 10 — 12 лет / 800 циклов | 10 — 12 лет / 800 циклов | 10 — 12 лет / 800 циклов |
| для электромоторов лодок и катеров | для глубоких циклических разрядов | для солнечных электростанций |
 Кадмий
КадмийКадмий (Cd) является мягким синевато-белым металлом. Обнаруженный в 1817 году в Германии, кадмий являлся побочным продуктом при производстве цинка, и использовался в основном как добавка к стали для предотвращения коррозии. Сейчас кадмий используется как материал для анода в никель-кадмиевых батареях [BU-203], но так как он является токсичным материалом, во многих странах его использование запрещено.
Кальций – это мягкий металл щелочной группы серого цвета. Его химическое обозначение — Са. Он был обнаружен английским химиком Хэмпфри Дэви в 1808 году. Это пятый самый распространенный по массе элемент в земной коре; он играет важнейшую роль для живых организмов, так как отвечает за формирование таких органов как кости, зубы и раковины. Кальций повышает производительность и механическую прочность свинцовых пластин в свинцово-кислотных электрических батареях.
 Марганец
МарганецМарганец (Mn) добывается вместе с железом и другими полезными ископаемыми. Он назван в честь древнегреческого города Магнесия, возле которого был найден черный минерал, содержащий этот металл. Марганец используется для предотвращения коррозии железа, а также служит в качестве катодного материала для литий-ионной [BU-205], угольно-цинковой [BU-106] и щелочной [BU-106] электрохимических схем.
Натрий (Na) — мягкий, серебристый, химически активный металл, который принадлежит к группе шести элементов с одним электроном на внешней оболочке. Теряя электрон, атом натрия становится положительно заряженным. Натрий является шестым самым распространенным элементом в земной коре, но доступен лишь в виде соединений. Он впервые был выделен Хэмпфри Дэви в 1807 году путем электролиза гидроксида натрия. Соединения натрия используются в производстве мыла и антиобледенительных веществ, но самым знаковым его применением является использование хлорида натрия, или по простому — кухонной соли.
Контроль и защита аккумуляторов
| Батарейный монитор | Защита от глубокого разряда | Батарейный балансир |
| контроль более 25 параметров, история и синхронизация | защита от низкого и высокого напряжения, возможность регулировки | для 12, 24, 36 и 48В систем, возможность параллельного подключения |
Из чего состоит корпус аккумулятора. Что внутри банок?
Корпус большинства аккумуляторов состоит из ударопрочного полипропилена. Этот материал выбран не случайно. Он легкий, а так же не вступает в химическую реакцию с агрессивным электролитом АКБ.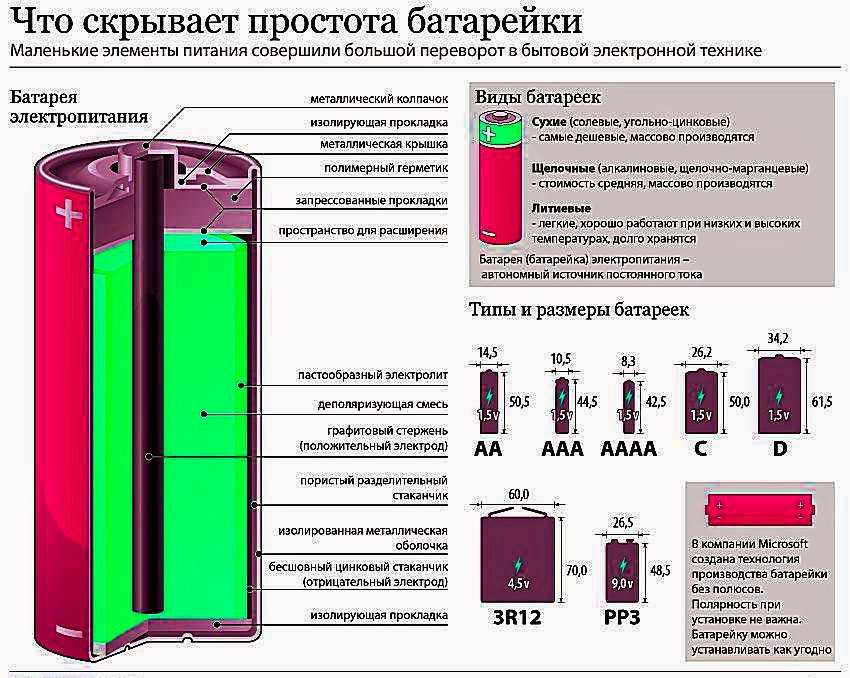 Полипропилен довольно стоек к перепадам температур, которые порой достигают диапазона от -30̊ С до +60 ̊С под капотом Вашего автомобиля.
Полипропилен довольно стоек к перепадам температур, которые порой достигают диапазона от -30̊ С до +60 ̊С под капотом Вашего автомобиля.
Давайте разберем из каких элементов состоит сам корпус аккумуляторной батареи.
Итак, большинство АКБ имеют такие элементы:
— ручка, которая используется для удобства переноса батареи человеком, что бы он не уронил случайно источник питания, который довольно прилично весит.
— пробки, 6 штук. Пробки позволяют проникнуть внутрь каждой секции (банки) аккумулятора. Когда мы открутим пробки, то сможем проверить уровень электролита, цвет его, плотность и определить в каком состоянии находится батарея.
— индикатор заряда или ещё часто называют «глазок». Он устанавливается на какую-то конкретную секцию батареи. Может быть на крайней банке АКБ или посередине, зависит от производителя и не имеет особого значения. Этот индикатор показывает уровень заряда батареи. Хочется обратить Ваше внимание, что «глазок» стоит только на одной банке, поэтому если соседняя секция замкнула, то Ваш индикатор может показывать что АКБ полностью исправен, а на самом деле это будет не так.
Поэтому, желательно проводить диагностику всех секций (банок) аккумулятора, нежели ориентироваться только на «глазок». Это даст более точную картину состояния аккумуляторной батареи.
— Также, на верхней поверхности любого аккумулятора есть клеммы. Через которые он и подключается к электросети автомобиля. Клеммы, в основном, стандартного размера, но плюсовой вывод всегда больше минусового по диаметру. Это сделано для того, что бы невнимательный водитель не перепутал полярность при установке АКБ на авто.
Корпус необслуживаемой АКБ
Давайте отметим, что много производителей аккумуляторных батарей делают необслуживаемые корпуса. К ним относятся такие «гиганты» как Varta, Bosch, Rocket, Mutlu и многие другие. В чём отличия обслуживаемых от необслуживаемых АКБ? Если есть пробки, которые откручиваются, то батарея подлежит обслуживанию. То есть, производитель рекомендует доливать дистилированую воду, когда она выкипит в процессе эксплуатации.
Завод-производитель необслуживаемых АКБ, вроде как, предусмотрел этот процесс. Вместо пробок они сделали систему клапанов. Эти клапаны не дают испарениям выйти из корпуса батареи, а они стекают обратно в банки. Обслуживания как такового не требуется, а только приодическая зарядка.
Вместо пробок они сделали систему клапанов. Эти клапаны не дают испарениям выйти из корпуса батареи, а они стекают обратно в банки. Обслуживания как такового не требуется, а только приодическая зарядка.
Что же под верхней крышкой?
Далее, если мы снимем верхнюю крышку АКБ, то мы увидим шесть секций. В каждой из этих банок находятся как положительные, так и отрицательные пластины. Каждая из этих пластин упакована в сепаратор. Сепаратор – это такой конверт, который предотвращает замыкание между пластинами.
В зависимости от того, сколько пластин положительных и отрицательных сложено в каждую секцию и соответственно мы получаем большую либо меньшую рабочую поверхность. И из этого складывается ёмкость самого аккумулятора. Соответственно, чем больше пластин тем больше ёмкость. Поэтому корпуса разные по размеру, в зависимости от ёмкости.
Каждая заряженая секция (банка) аккумулятора имеет напряжение 2,13 В. Так как автомобильный АКБ 12-ти вольтовый, мы имеем 6 таких секций и полностью заряженный источник питания имеет напряжения около12,78 В.
Электролит
Электролит — химический элемент, который служит проводником электрического тока. Он состоит из двух компонентов это серная кислота и вода. Оптимальное соотношение электролита, которое необходимо для нормального функционирования аккумуляторной батареи 1,27 грамма кислоты на см3 воды.
Электролит различают трех видов:
1. Жидкий электролит;
2. В виде геля;
3. Абсорберы или связанный электролит.
Давайте разберем более подробно каждый из видов.
Жидкий электролит
Это обычный раствор кислоты и воды, который находится в жидком состоянии в АКБ. Такие батареи у большинства автовладельцев.
Гелевый электролит
Как Вы уже догадались у самого слова «гелевый», означает что он находится в загущенном состоянии, в виде геля. Какие преимущества этих аккумуляторов? Преимущества их в том что, как правило, они имеют герметичный корпус, то есть, полностью запаянный, доступа к банкам или к секциям аккумулятора у них нет. И за счет того, что электролит находится в густом состоянии, он не вытекает. То есть, при кипении аккумулятора, допустим генератор подаёт большое напряжения, он перезаряжается. Начинают накапливаться газы и происходить перезаряд, то обычный электролит начинает обильно кипеть. В результате кипения испаряется вода. И из-за перезаряда (неисправного генератора) аккумулятор выходит из строя. В гелевых батареях это происходит не таким образом. Аккумулятор имеет более густой электролит, не так подвержен кипению, корпус герметичный и все процессы циркулируют внутри самого корпуса. И нет выкипания воды из геля. Даже если в корпусе образовалось какое-то отверстие, батарея не теряет свою работоспособность. Он может потерять только ёмкость, если мы механически повредили секции внутри.
И за счет того, что электролит находится в густом состоянии, он не вытекает. То есть, при кипении аккумулятора, допустим генератор подаёт большое напряжения, он перезаряжается. Начинают накапливаться газы и происходить перезаряд, то обычный электролит начинает обильно кипеть. В результате кипения испаряется вода. И из-за перезаряда (неисправного генератора) аккумулятор выходит из строя. В гелевых батареях это происходит не таким образом. Аккумулятор имеет более густой электролит, не так подвержен кипению, корпус герметичный и все процессы циркулируют внутри самого корпуса. И нет выкипания воды из геля. Даже если в корпусе образовалось какое-то отверстие, батарея не теряет свою работоспособность. Он может потерять только ёмкость, если мы механически повредили секции внутри.
Плюс еще в том, что в загущеном состоянии проводимость тока у него улучшается. В таком электролите более быстро происходят химические реакции. АКБ быстрее отдает ток, который необходим и так же быстрее его восстанавливает. Гелевые аккумуляторы, как правило, заряжаются во много раз чем обычный кислотный.
Гелевые аккумуляторы, как правило, заряжаются во много раз чем обычный кислотный.
Также, к достоинствам нужно отнести, что они не боятся глубокого разряда. У них не происходит, в таких случаях сульфатация пластин. И имеют высокий пусковой ток.
Технология AGM
Так называемые абсорберы или связанный электролит. В чем их отличия? Сепаратор или «конверт» в который укладывается пластина, состоит из микроволокна, похожего на стекловату. Если мы на стекловату добавим какую-то жидкость, то капельки будут находится на маленьких ворсинках из которых состоит структура самого сепаратора. Получается что электролит не в жидком состоянии бультыхается как вода, а держится на ворсинках материала. Он вроде как жидкий, но в то же время не вытекает.
Преимущества схожи с гелевыми АКБ. Они тоже не так боятся повреждения корпуса батареи, меньше подвержены сульфатации пластин. Выкипания воды практически нет.
Также на эту тему:
Устройство и история автомобильных аккумуляторов
21. 09.2012
#АКБ
# Аккумулятор
09.2012
#АКБ
# Аккумулятор
Аккумулятор электрический (лат. accumulator собиратель, от лат. accumulo собираю, накопляю) — химический источник электрического тока. Главным достоинством аккумуляторов является обратимость химической реакции, т.е. данный источник тока можно не только разряжать, но и заряжать повторно. Благодаря этому свойству аккумуляторы используются в наши дни почти во всех электрических и электронных устройствах — везде, где экономически выгоднее зарядить прежний источник тока, чем покупать новый.
В автомобилях также имеется аккумулятор. Он используется при заводе двигателя, а также в качестве источника электрической энергии на пару с электрогенератором. Однако нужно учесть, что автомобилю требуется ток высокой силы.
Отдельные аккумуляторы в батареях сделаны в виде «банок» (ячеек) с помещенными внутри них электродами и залитых электролитом. У каждой «банки» имеется два контакта — положительный и отрицательный. Далее эти контакты последовательно соединены в единую цепь и выведены наружу аккумуляторной батареи в виде общих для АКБ контактов. Каждая такая секция-аккумулятор выдает напряжение в 2 вольта.
Для получения необходимого напряжения в 12 вольт последовательно соединяют шесть таких «банок». Именно на 12 вольт рассчитано электрооборудование почти всех легковых и некоторых легкогрузовых автомобилей. На большинстве тяжелых грузовиков электротехника рассчитана на 24 вольт.
Схема автомобильной аккумуляторной батареи
- Корпус аккумуляторной батареи
- «+» выход АКБ
- «−» выход АКБ
- Анод — положительная пластина
- Катод — отрицательная пластина
- Пробки для обслуживания АКБ
(на необслуживаемых моделях отсутствуют)
Существует множество разновидностей аккумуляторов, различаемых по материалу анода и катода, а также используемому электролиту. В наше время в автомобилях чаще всего используются свинцово-кислотные аккумуляторы, в которых материалом электродов является свинец с разнообразными добавками, а электролитом — водный раствор серной кислоты.
Раньше электроды отливали из чистого свинца, однако он не отличается высокой прочностью и устойчивостью к вибрациям, непременно возникающим при работе двигателя и движении транспортного средства. Поэтому в свинец стали добавлять различные добавки, чтобы увеличить прочность электродов. В качестве такой присадки активно и долгое время использовалась сурьма (в Европе и США — до середины 20 века, в СССР — вплоть до 90-х годов 20 века).
Однако, хоть прочность пластин-электродов и была увеличена, возник побочный эффект — гидролиз воды при зарядке АКБ стал происходить при гораздо более низких значениях напряжения. Из-за гидролиза часть воды улетучивалась в виде газообразных кислорода и водорода. Мало того, что постоянно требовалось следить за уровнем воды в банках, так еще была реальная опасность взрыва, так как кислород и водород, при смешении в определенной пропорции, образуют так называемый «гремучий газ».
Для решения этой проблемы производители применяли различные решения. На некоторых АКБ стали вместо сурьмы использовать добавку из кальция. Это позволило избавиться от повышенного газообразования, но сделало аккумулятор более чувствительным к переразрядам и перезарядам. Наряду с использованием добавок из кальция, также, в качестве альтернативного решения проблемы, стали выпускать малосурьмянистые пластины. Все это позволило увеличить напряжение электролиза с прежних 12 вольт до 16 вольт и выше. А это уже давало возможность свести потери воды практически к нулю, т.е. стал возможен выпуск аккумуляторных батарей, которые не требовали контроля уровня электролита в банках.
На некоторых АКБ стали вместо сурьмы использовать добавку из кальция. Это позволило избавиться от повышенного газообразования, но сделало аккумулятор более чувствительным к переразрядам и перезарядам. Наряду с использованием добавок из кальция, также, в качестве альтернативного решения проблемы, стали выпускать малосурьмянистые пластины. Все это позволило увеличить напряжение электролиза с прежних 12 вольт до 16 вольт и выше. А это уже давало возможность свести потери воды практически к нулю, т.е. стал возможен выпуск аккумуляторных батарей, которые не требовали контроля уровня электролита в банках.
Еще одной из проблем являлось постепенное разрушение активной массы и накопление образовавшегося шлама на дне корпуса АКБ и последующее замыкание пластин, вызывающее уменьшение полезной площади, участвующей в накоплении энергии. Первым решением этой проблемы было создание под пластинами специальных канавок, чтобы там могла скапливаться осыпавшаяся активная масса. Разумеется, необходимость резервировать место для шлама приводила либо к увеличению габаритов корпуса АКБ, либо уменьшению полезной площади пластин. И вот было найдено более изящное решение проблемы осыпания электродов: каждую пластину поместили в конверт из пористого материала, свободно пропускающего электролит, но задерживающего частички активной массы электродов. Теперь, даже если происходило частичное осыпание свинцовой смеси с поверхности пластины-электрода, весь этот мусор не падал на дно АКБ, а оставался внутри конверта. Это позволило исключить возможность короткого замыкания. Электроды теперь можно было располагать гораздо ближе друг к другу и крепить прямо ко дну банки. Освободившееся место позволило увеличить полезную площадь пластин.
И вот было найдено более изящное решение проблемы осыпания электродов: каждую пластину поместили в конверт из пористого материала, свободно пропускающего электролит, но задерживающего частички активной массы электродов. Теперь, даже если происходило частичное осыпание свинцовой смеси с поверхности пластины-электрода, весь этот мусор не падал на дно АКБ, а оставался внутри конверта. Это позволило исключить возможность короткого замыкания. Электроды теперь можно было располагать гораздо ближе друг к другу и крепить прямо ко дну банки. Освободившееся место позволило увеличить полезную площадь пластин.
Но все эти улучшения касались лишь электродов, в то время как электролит — серная кислота — по-прежнему использовался в том же самом виде — в виде водного раствора. Из-за того, что электролит находится в АКБ в жидком виде, с автомобильными аккумуляторами приходится обращаться крайне аккуратно, т.к. серная кислота — агрессивное вещество и способно серьезно повреждать практически всё, что с ней контактирует. Автомобилисты знают, что аккумуляторы крайне нежелательно трясти и наклонять на большой угол, чтобы электролит не проник в каналы в крышке, а потом и наружу АКБ. Также очень опасна была ситуация, когда повреждалась стенка батареи. Электролит вытекал наружу и повреждал все вокруг.
Автомобилисты знают, что аккумуляторы крайне нежелательно трясти и наклонять на большой угол, чтобы электролит не проник в каналы в крышке, а потом и наружу АКБ. Также очень опасна была ситуация, когда повреждалась стенка батареи. Электролит вытекал наружу и повреждал все вокруг.
Для решения данной проблемы искали способы отойти от использования электролита в жидком виде. В результате стали использовать серную кислоту в виде геля. В аккумуляторах данного типа кислота загущается до состояния геля путем добавления специального вещества — силикагеля (SiO2). Гелевые аккумуляторы часто можно узнать по обозначению «GEL» на корпусе АКБ.
Еще одной из новинок на рынке является появление аккумуляторов, изготовленных по технологии AGM (Absorbent Glass Mat) — использование абсорбирующего стекломатериала. В АКБ данного типа электролит находится в абсорбированном виде.
AGM аккумуляторные батареи
В гелевых и AGM-аккумуляторах физически отсутствует возможность регулирования уровня и концентрации электролита, т.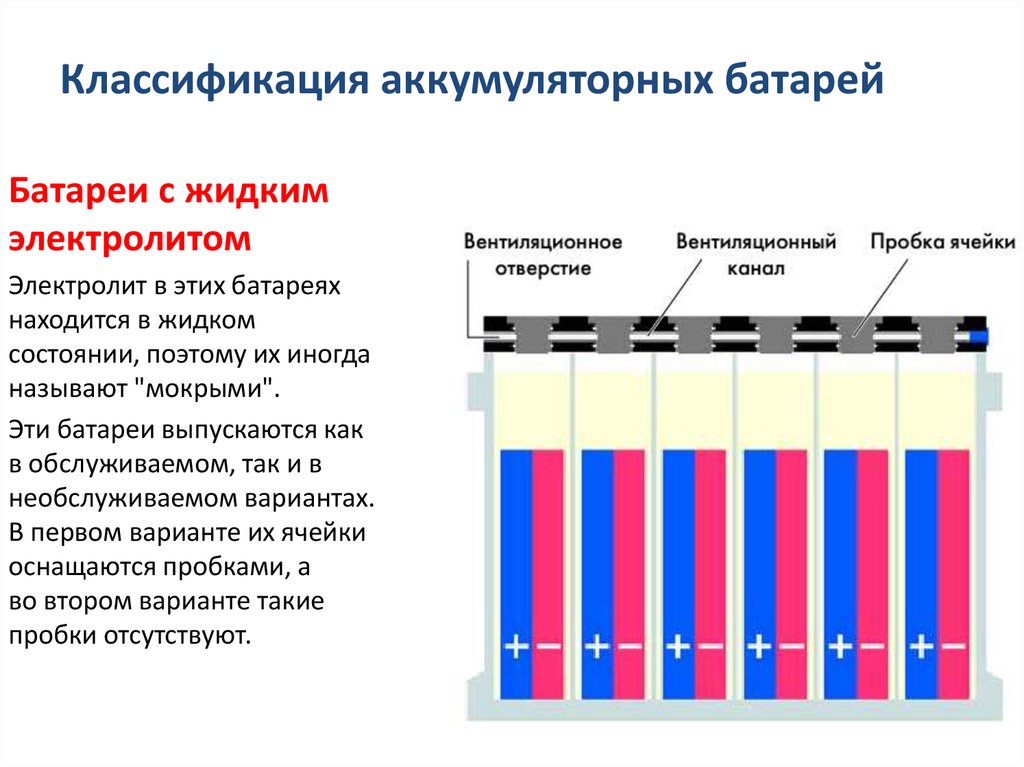 е. данные АКБ являются полностью необслуживаемыми.
е. данные АКБ являются полностью необслуживаемыми.
Несмотря на все это великое множество моделей АКБ, в основе их работы лежат одни и те же химические процессы:
При разряде происходит реакция между серной кислотой, оксидом свинца и свинцом. При этом образуются сульфат свинца, выделяется вода и образуется разность потенциалов (электрический ток). В результате разложения серной кислоты и выделения воды снижается концентрация электролита, что может при длительном разряде привести к прекращению работоспособности аккумулятора. Для предотвращения этого не стоит доводить состояние АКБ до полного разряда.
Суммарный химический процесс при разряде аккумулятора:
Pb + PbO2 + 2H2SO4 → 2PbSO4 + 2H2O
При заряде, наоборот, нужно затратить электрический ток для восстановления свинца из сульфата и образования серной кислоты. Это позволяет восстановить концентрацию электролита и подготовить аккумуляторную батарею к повторному использованию (разряду).
Суммарный химический процесс при заряде аккумулятора:
2PbSO4 + 2H2O → Pb + PbO2 + 2H2SO4
Однако не всегда в качестве электролита использовался раствор серной кислоты. Первые аккумуляторы заливались подкисленной водой.
История аккумуляторных батарей отсылает нас в 1859 год, когда французским физиком Гастоном Планте была создана первая аккумуляторная батарея. Химический способ получения электрического тока был известен еще до него: в 1800 году Алессандро Вольта построил свою химическую батарею — знаменитый «Вольтов столб». Но данное устройство получения электричества было однократного действия, не перезаряжаемым.
Аккумуляторная батарея Гастона Планте
Аккумулятор Гастона Планте состоял из пары свинцовых пластин, разделенных тканью и обернутых вокруг деревянного цилиндра. Электролитом была подкисленная вода. Аккумуляторная батарея Планте была дорога в изготовлении и сложна в эксплуатации. Ситуацию изменило изобретение Камилло Фора, работавшего у Гастона Планте и знакомого с его детищем. Фор нашел способ уменьшить стоимость изготовления, а также увеличить энергоемкость аккумулятора. Вместо свинцовой ленты, намотанной вокруг цилиндра, он предложил формировать из свинца решетчатые пластины, покрытые оксидом свинца. Т.е. Камилло Фор получил аккумуляторную батарею практически в том виде, в котором мы ее знаем сейчас.
Ситуацию изменило изобретение Камилло Фора, работавшего у Гастона Планте и знакомого с его детищем. Фор нашел способ уменьшить стоимость изготовления, а также увеличить энергоемкость аккумулятора. Вместо свинцовой ленты, намотанной вокруг цилиндра, он предложил формировать из свинца решетчатые пластины, покрытые оксидом свинца. Т.е. Камилло Фор получил аккумуляторную батарею практически в том виде, в котором мы ее знаем сейчас.
В наши дни не прекращаются исследования по улучшению аккумуляторных батарей. Изыскиваются способы уменьшения размеров устройства, увеличения емкости и снижения чувствительности к перепадам температуры. Скорее всего, в скором будущем свинцово-кислотные аккумуляторные батареи уступят место в автомобиле более совершенным, построенным по другой технологии. Ну а пока этого не произошло, автомобили будут комплектоваться различными воплощениями старой, свинцово-кислотной, технологии.
#Стойка стабилизатора Nissan
Стойка стабилизатора Nissan: основа поперечной устойчивости «японцев»
22. 06.2022 | Статьи о запасных частях
06.2022 | Статьи о запасных частях
Ходовая часть многих японских автомобилей Nissan оснащается стабилизатором поперечной устойчивости раздельного типа, соединенным с деталями подвески двумя отдельными стойками (тягами). Все о стойках стабилизатора Nissan, их типах и конструкции, а также о подборе и ремонте — читайте в данной статье.
#Ремень приводной клиновой
Ремень приводной клиновой: надежный привод агрегатов и оборудования
15.06.2022 | Статьи о запасных частях
Для привода агрегатов двигателя и в трансмиссиях различного оборудования широко применяются передачи на основе резиновых клиновых ремней. Все о приводных клиновых ремнях, их существующих типах, особенностях конструкции и характеристиках, а также о правильном выборе и замене ремней — читайте в статье.
Барабан тормозной ГАЗ: управляемость и безопасность горьковских автомобилей
08.06.2022 | Статьи о запасных частях
Тормозные системы большинства ранних и актуальных моделей автомобилей ГАЗ оснащаются колесными механизмами барабанного типа. Все о тормозных барабанах ГАЗ, их существующих типах, конструктивных особенностях и характеристиках, а также о выборе, замене и обслуживании данных деталей — читайте в статье.
Все о тормозных барабанах ГАЗ, их существующих типах, конструктивных особенностях и характеристиках, а также о выборе, замене и обслуживании данных деталей — читайте в статье.
#Палец поршневой
Палец поршневой: прочная связь поршня и шатуна
02.02.2022 | Статьи о запасных частях
В любом поршневом двигателе внутреннего сгорания присутствует деталь, соединяющая поршень с верхней головкой шатуна — поршневой палец. Все о поршневых пальцах, их конструктивных особенностях и способах установки, а также о верном подборе и замене пальцев различных типов подробно рассказано в статье.
Вернуться к списку статей
Какая кислота в аккумуляторе автомобиля и какова ее плотность
Главная » Технологии
Владельцы автомобилей часто задаются вопросом о том, какая кислота в аккумуляторе автомобиля, от которой зависит срок его службы. Производители этой продукции в основном заливают серную кислоту, представляющую кислотно-водный раствор определенной плотности и концентрации. Она называется электролитом, и для контроля его качества следует знать определенные особенности обращения, проверки и технические характеристики. В некоторых АКБ используется щелочной электролит, состоящий из элементов лития, натрия, калия и их комбинаций. В основном это сухозаряженные источники питания, которые применяются в суровых климатических условиях.
Она называется электролитом, и для контроля его качества следует знать определенные особенности обращения, проверки и технические характеристики. В некоторых АКБ используется щелочной электролит, состоящий из элементов лития, натрия, калия и их комбинаций. В основном это сухозаряженные источники питания, которые применяются в суровых климатических условиях.
Содержание
- Состав электролита
- Контроль плотности
- Составляющий компонент строения АКБ
- Нейтрализация электролита
Состав электролита
Электролит, или серная кислота используется современной промышленностью для производства источников тока:
- в батареях;
- аккумуляторах;
- электрических конденсаторах.
В аккумуляторы заливается серная кислота разбавленного соотношения с водой — примерно 70% воды, 30% H2SO4. При ее отсутствии устройство не пригодно к работе. Особого внимания также заслуживает плотность жидкости, которую следует проверять и при необходимости увеличивать.
Контроль плотности
Плотность в автомобильном свинцово-кислотном аккумуляторе измеряют в гр/см³, и она должна быть пропорциональна концентрации раствора с обратной зависимостью температур жидкости. Нормальный показатель — 1,27-1,29 гр/см³. Этот показатель позволяет определить состояние батареи, и если она не держит заряда, то необходимо проверить количество вещества. Со временем уровень электролита аккумулятора автомобиля сокращается, и соответственно, увеличивается плотность при гидролизе воды и нагрева. Для этого требуется периодически доливать дистиллированную воду, снижая концентрацию серной кислоты. Процедуру можно выполнить самостоятельно, если знать, сколько требуется для определенной модели вещества.
Электролит для аккумуляторов можно приобрести в магазинах, либо сделать своими руками и научиться регулировать плотность, своевременно измерять и ухаживать за устройством для продления срока службы.
Для приготовления потребуются следующие компоненты:
- Серная кислота.

- Вода дистиллированная.
- Емкость из стекла, свинца, керамики, устойчивая к воздействию химического вещества.
- Эбонитовая баночка для размешивания.
Для приготовления в емкость заливается дистиллированная вода, затем серная кислота, и палочкой параллельно помешивается получаемая смесь. Процедуру проводят последовательно, так как при обратном варианте можно получить ожоги. Если места эксплуатации автотранспорта климат умеренный, то следует придерживаться такой пропорции веществ: на 1 л воды — 0,36 л кислоты. Для теплого климата на 1 л воды следует заливать кислоту в объеме 0,33 л. Полученное вещество накрывается и оставляется на сутки до образования осадков и остывания. При замене электролита в аккумуляторе надевают резиновые перчатки и очки для защиты глаз.
Напомним, что при обратном проведении заливки, в частности, первой воды, возможна реакция гидратации и образования тепла в кислоте. Вероятно, что вода закипит и спровоцирует разбрызгивание.
Вероятно, что вода закипит и спровоцирует разбрызгивание.
Проверять плотность аккумулятора необходимо раз в три месяца. Для этого пользуются ареометром.
Составляющий компонент строения АКБ
Без наличия в аккумуляторе электролита не будет выполняться его основная функция, так как вещество является активатором заряда и разряда. В емкости устройства жидкости должно быть много, и, соответственно, вес аккумулятора не маленький. Примерное соотношение конструкции представляет до 20 % веса жидкости, до 25 % пластика и свинцовая составляющая достигает до 80 % веса. Плюсовые пластины состоят из диоксида свинца, минусовые монолитные пластины — чистый свинец. Пластины служат для сборки пакетов, способствующих накоплению заряда.
Следует отметить, что АКБ различается по моделям, и, в частности, модель 55 А/ч относится к одной из самых легких, какую можно встретить в легковых автомобилях достаточно часто. Ее вес не превышает 16 кг. Есть более компактные модели с незначительным весом, как, например, 40 А/ч и другие варианты.
Нейтрализация электролита
Если аккумулятор вышел полностью из строя, его требуется утилизировать грамотно. Но также в случае течи электролита из батареи необходимо узнать, чем нейтрализовать ее.
Бывают ситуации, когда при поломке аккумулятора может быть залита отдельная часть в месте его нахождения. Для этого необходимо вытащить батарею и провести очистку. Нейтрализация этого вещества из аккумулятора, как правило, проводится при помощи специального оборудования и применения технологий. Это важно с экономической и экологической точек зрения. Если проводить неорганизованную нейтрализацию, можно нанести значительный вред окружающей среде.
В настоящее время имеются два варианта нейтрализующего вещества с кислотами промышленным способом. Первый предусматривает устранение фильтрующим методом сброса кислоты в стоки, с пропусканием через магнезит, известняк и другие материалы, а второй способ – регенерация кислоты специальной обработкой с последующим получением товарного продукта. Но на практике многие водители рекомендуют в случае пролива опасного вещества использовать щелочный раствор, который делается из пищевой соды и воды.
Но на практике многие водители рекомендуют в случае пролива опасного вещества использовать щелочный раствор, который делается из пищевой соды и воды.
При регулярной проверке аккумулятора, в том числе контроле за плотностью и уровнем электролита, можно избежать многих проблем и продлить срок эксплуатации батареи, не допустить механических разрушений. Всегда требуется внимательно относиться к устройствам при эксплуатации, особенно в зимнее время, когда при низких температурах и сниженной плотности электролита может произойти его замерзание или разрушение пластин.
Как вам статья?
Похожие статьи
Рейтинг
( Пока оценок нет )
аккумулятор автомобиля электролит
Какую кислоту заливают в автомобильный аккумулятор
Каждому автомобилисту хорошо знакома проблема износа ресурса аккумуляторной батареи. Её приходится периодически заряжать, доливать специальную жидкость либо же вовсе приобретать новую.
Её приходится периодически заряжать, доливать специальную жидкость либо же вовсе приобретать новую.
Ресурс во многом зависит от того, в каком состоянии находится электролит. Это кислотно-водный раствор, находящийся внутри батареи.
Чтобы осуществлять контроль, требуется знать об особенностях используемой кислоты, её свойствах, характеристиках и понимать, как следует обслуживать АКБ в тех или иных ситуациях.
Зачем используется кислота
В упрощённом виде АКБ можно представить как обычную батарейку. Внутри располагается катод, анод и аккумуляторная жидкость. Она же электролит.
В состав электролита входит кислота и дистиллированная вода, смешанные в определённых пропорциях. Чтобы понять назначение кислоты, необходимо взглянуть на основные процессы, активно протекающие при разряде и заряде АКБ.
Кислота нужна для того, чтобы обеспечить появление тока. Она вступает в реакции с оксидами и металлами, что позволяет создать условия для работы устройства.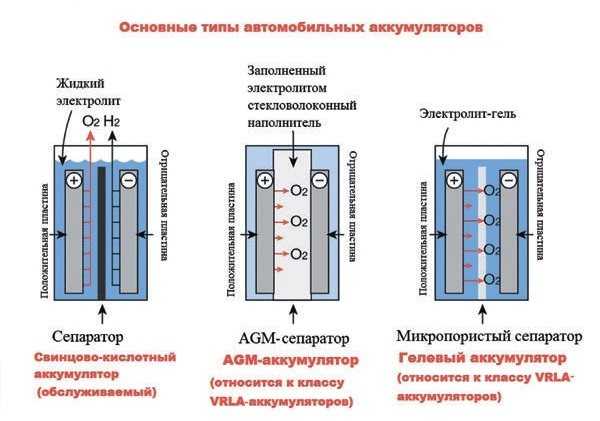
Подключая внешнюю нагрузку, реакция жидкости с оксидами и со свинцом запускает необходимые окислительно-восстановительные реакции. Причём они являются противоположными в зависимости от того, заряжается или разряжается батарея. Образование тока происходит за счёт выделения положительных электронов из свинца и приёма оксидов от отрицательной пластины. Передаются заряженные частицы за счёт электролита, залитого в АКБ.
В батарее предусмотрены контакты, на которых протекают различные процессы. А именно:
- расходуется триоксид серы;
- происходит восстановление оксида свинца на катоде;
- выделяется вода;
- появляется окись металла на аноде.
То есть при возникновении реакции кислота замещается водой. Из-за этого плотность электролита снижается. Если идёт заряд, процессы протекают в обратном направлении. Затем ток провоцирует электролиз, при котором вещество распадается на компоненты. Это кислород и водород. Они выделяются в газовом агрегатном состоянии. Потому раствор закипает. Вещества выходят из жидкости и обратно не возвращаются. От этого плотность увеличивается, поскольку оставшаяся в батарее кислота тяжёлая. Чтобы вернуть прежние параметры и восстановить баланс для лучшей работы АКБ, в неё требуется добавить воду.
Потому раствор закипает. Вещества выходят из жидкости и обратно не возвращаются. От этого плотность увеличивается, поскольку оставшаяся в батарее кислота тяжёлая. Чтобы вернуть прежние параметры и восстановить баланс для лучшей работы АКБ, в неё требуется добавить воду.
В АКБ допускается применение только дистиллированной воды. В обычной водопроводной воде содержится большое количество примесей, при контакте с которыми батарея быстро выйдет из строя.
Применяемый вид кислоты
Одним из самых распространённых вопросов об АКБ является то, какую кислоту используют в аккумуляторе автомобиля.
Здесь есть разные теории и догадки. Одни считают, что в аккумуляторе автомобиля применяется сугубо соляная кислота. Другие, отвечая на вопрос о том, какая там кислота, говорят, что серная.
Нельзя сказать, что вопрос принципиальный для обычного автолюбителя, поскольку в чистом виде иметь дело с кислотой ему вряд ли придётся. Но при этом стоит знать, какая именно кислота находится в аккумуляторе. Это не соляная, а серная.
Это не соляная, а серная.
У серной кислоты есть ещё и другие названия. Это ангидрид или триоксид серы. Но наиболее распространена среди обывателей именно серная кислота.
Если у вас вдруг спросят, какая кислота в действительности заливается в автомобильный аккумулятор, смело и уверенно отвечайте, что серная.
Существуют различные виды АКБ, где могут применяться иные жидкости в качестве электролита. В никель-кидмиевых устройствах это щёлочь. Есть и гелевые аппараты, где электролит имеет достаточно вязкую структуру, хотя по сути внутри находится та же кислота.
Если же говорить о том, какую кислоту на производстве заливают именно в свинцово-кислотный аккумулятор, используемый на автомобилях, то это будет серная.
Концентрация вещества в электролите составляет от 30 до 35%. Всё остальное приходится на дистиллированную воду.
В редких случаях с завода концентрация кислоты превышает 35%. Для решения задач, стоящих перед автомобильными АКБ, даже 30% вполне достаточно.
Зная теперь, какая именно кислота используется в автомобильных аккумуляторах, в какой концентрации и соотношении, можно переходить к ответам на другие вопросы.
Объективно недостаточно знать лишь то, какую кислоту при производстве батарей для автомобиля заливают в аккумулятор и какое альтернативное название она носит. Если вы планируете самостоятельно обслуживать и контролировать состояние АКБ, следует несколько расширить базу своих знаний. В последующем вам предстоит добавлять в АКБ электролит или просто подливать воду. Это вполне обычный процесс для обслуживаемых батарей.
Концентрация и плотность
Концентрацией называют соотношение кислоты и дистиллированной воды. Чтобы не возникало сложностей с приготовлением раствора, в продаже доступны уже полностью готовые к использованию электролиты.
Но объективно самым важным параметром для АКБ считается плотность электролита.
Нормальным считается показатель в пределах от 1,07 до 1,3 г/см3.
Меняя параметры, меняется и порог замерзания.
Плотность также влияет на электропроводимость, являющуюся обратно пропорциональной сопротивлению в автомобильной батарее.
Когда машина эксплуатируется в условиях низких температур, плотность рекомендуется поднять примерно до 1,3 г/см3. Да, с позиции показателей электропроводимости это не лучшее решение. Но если снизить плотность, жидкость может попросту замёрзнуть. А замерзание влечёт за собой разрыв банок и полный выход из строя АКБ.
Оптимальной же плотностью при минимальном сопротивлении считается 1,23г/см3.
В продаже представлены электролиты разной плотности, в зависимости от сезона, для которого они предназначены. Выбирайте те, которые соответствуют текущим погодным условиям.
Применение правильного электролита существенно продлевает срок службы всего аккумулятора.
Контроль состояния
Одной из главных задач, стоящей перед автовладельцем, под капотом машины которого установлена свинцово-кислотная обслуживаемая батарея, является своевременный контроль состояния электролита.
Помимо уровня, необходимо следить и за показателями плотности.
Уровень проверяется довольно просто. Для этого потребуется взять стеклянную трубочку или корпус от прозрачной ручки. Далее выполняются такие операции:
- откручиваются пробки на всех банках АКБ;
- трубочка погружается в батарею до уровня пластин;
- верхний конец трубочки зажимается плотно пальцем;
- измерительный прибор поднимается.
Принято считать, что оптимальный уровень должен составлять в пределах от 10 до 15 миллиметров.
Если проверка показала меньшее значение, тогда необходимо долить электролит. Заливать выше оптимального уровня также не рекомендуется.
Срок службы
Теперь вы знаете, какую кислоту при производстве и дальнейшем обслуживании добавляют в автомобильный аккумулятор.
Ведётся много споров касательно того, какой эксплуатационный период у раствора. На самом деле срока годности он не имеет. Период службы определяется эффективностью выполняемых функций. Пока электролит справляется со своими задачами, он считается пригодным к использованию.
Пока электролит справляется со своими задачами, он считается пригодным к использованию.
Срок службы вещества зависит от:
- плотности используемого электролита;
- температуры, в которой эксплуатируется батарея;
- уровня заряда АКБ.
Если поддерживать эти параметры в оптимальных значениях, тогда и кислота будет служить достаточно долго.
Повышение плотности электролита
Если текущая плотность используемой кислоты в аккумуляторе автомобиля очень высокая, тогда достаточно добавить в банки воды, и показатели будут оптимизированы.
Но в обратном направлении этот приём не работает. Добавляя воду, увеличить кислотность точно не получится.
Плотность вещества в АКБ регулируется уровнем заряда АКБ.
Объяснить это просто. По завершению окислительно-восстановительных реакций вода может распадаться и теряться. Из-за этого концентрация кислоты будет увеличиваться. Используя зарядные устройства, можно компенсировать недостаточную плотность.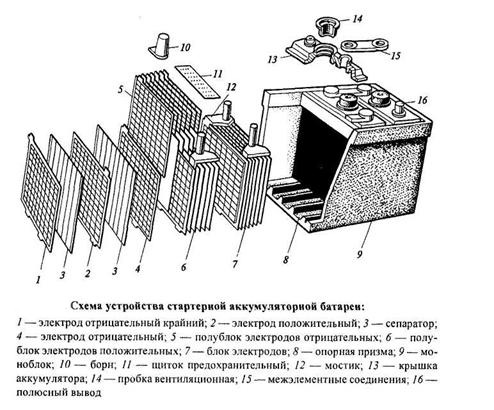 Если этот метод не помогает, тогда в батарею требуется залить электролит корректирующего типа.
Если этот метод не помогает, тогда в батарею требуется залить электролит корректирующего типа.
На практике концентрация обычно повышается путём полной замены электролита либо же за счёт добавления разбавленной кислоты.
Используя метод разбавления, нужно выполнить такие операции, причём для каждой банки аккумуляторной батареи:
- С помощью шприца или медицинской груши постепенно откачать максимально возможное количество жидкости.
- Добавить в банку половину её объёма разбавленную концентрированную кислоту с плотностью около 1,26-1,28 г/см3.
- Подать нагрузку на выводы с минимальной мощностью, что позволит тщательно перемешать компоненты.
Замеряя плотность, не забывайте проверять уровень. Если после проведённых манипуляций никаких изменений не наблюдается, тогда добавляется ещё часть электролита. Постепенно контролируя параметры аккумулятора, создаются оптимальные значения концентрации.
Если при проверке плотности обнаруживаются значения ниже 1,2 г/см3, тогда выход только один. Это полная замена электролита, поскольку путём разбавления повысить уровень до нужных значений уже не получится.
Это полная замена электролита, поскольку путём разбавления повысить уровень до нужных значений уже не получится.
Серная кислота, даже в разбавленном виде, очень концентрированная и опасная для кожных покровов и слизистых оболочек.
В процессе работы нужно обязательно предварительно подумать о средствах защиты. Работать с электролитом лучше в резиновых перчатках, очках и в прорезиненном фартуке.
Как правильно заливать и доливать раствор
Особой потребности отдельно приобретать серную кислоту и дистиллированную воду не обязательно. Последняя находится в свободной продаже, в то время как кислоты заполучить намного сложнее.
Поэтому для автомобилистов просто продают уже готовые растворы электролита. Их смешивают в соответствующих пропорциях, и получают составы для разных ситуаций и времени года. К примеру, для получения электролита плотностью 1,29 г/см3, на 1 литр дистиллята добавляется 360 мл. кислоты. То есть здесь соотношение составляет 1 к 3.
Техника безопасности гласит, что добавлять при смешивании можно только кислоту в воду. Добавлять воду в кислоту запрещается, поскольку есть высокая вероятность возникновения реакции, при которой будет выделяться тепло и брызги.
Это потенциально очень опасно для человека. Поэтому запомните, что только в воду добавляется кислота, а не наоборот.
Сам же процесс заливки и доливки выглядит следующим образом:
- Заливать или доливать электролит рекомендуется с помощью полиэтиленовой или стеклянной трубки.
- Уровень вещества в аккумуляторе автомобиля должен находиться в пределах от 10 до 15 мм над пластинами из свинца.
- Добавив необходимое количество раствора, аккумулятор стоит оставить в покое примерно на 2 часа. Но бывает так, что за это время плотность успевает упасть.
- Затем аккумулятор следует зарядить током. Его значение должно быть в 10 раз меньше, чем ёмкость батареи.
- Зарядка на низком токе продолжается в течение 4 часов.

С целью профилактики и поддержания оптимального состояния, проверка плотности проводится с интервалом в 2-3 месяца. Минимум 3-4 раза в год этот показатель нужно обязательно проверять. Сделать это можно с помощью ареометра.
Как сделать электролит
Создавать себе дополнительные трудности хотят далеко не все. Поэтому самым простым решением станет покупка уже готового раствора из дистиллированной воды и серной кислоты в специализированных магазинах.
Но есть и те, кто предпочитает всё делать своими руками, чтобы быть уверенным в качестве, или просто имея желание научиться чему-то новому.
Чтобы приготовить электролит, потребуется подготовить набор, состоящий из:
- дистиллированной воды;
- серной кислоты;
- ёмкости из подходящего материала;
- эбонитовой палочки.

Касательно ёмкости определиться не сложно. Обычно применяют тару из керамики или стекла. Заливать состав в обычную пластиковую бутылку нельзя. Её может разъесть, и вещество выльется. А эбонитовая палочка выполняет функцию инструмента для перемешивания.
В подготовленную ёмкость заливается вода, а уже в воду постепенно добавляется кислота. В зависимости от необходимой плотности, компоненты смешиваются в соответствующих пропорциях. Чаще всего это 1 к 3, где воды в 3 раза больше, чем кислоты.
Но сразу после перемешивания заливать жидкость в аккумулятор нельзя. Необходимо плотно накрыть крышкой ёмкость и оставить минимум на 24 часа. Это требуется, чтобы состав остыл и выпал весь осадок. Всё, раствор готов к использованию.
Как видите, не так всё просто с этими свинцово-кислотными аккумуляторами. Они относятся к категории обслуживаемых, а потому требуют к себе повышенного внимания и периодического контроля. Проверять уровень не сложно, а вот перспектива заливать электролит или добавлять постоянно воду привлекает далеко не всех.
Поэтому всё чаще автовладельцы отказываются от обслуживаемых АКБ и переходят на более современные аналоги, в которых следить требуется только за уровнем заряда. Ничего заливать, добавлять и смешивать уже не нужно.
Что такое батарея? — Learn.sparkfun.com
Авторы: Шон Хаймел
Избранное Любимый 23
Введение
Батареи представляют собой набор из одной или нескольких ячеек, химические реакции которых создают поток электронов в цепи. Все батареи состоят из трех основных компонентов: анода (сторона «-»), катода (сторона «+») и электролита (вещество, которое химически реагирует с анодом и катодом).
Когда анод и катод батареи подключены к цепи, между анодом и электролитом происходит химическая реакция. Эта реакция заставляет электроны течь по цепи и возвращаться к катоду, где происходит другая химическая реакция. Когда материал в катоде или аноде расходуется или больше не может использоваться в реакции, батарея не может производить электричество. В этот момент ваша батарея «умерла».
Эта реакция заставляет электроны течь по цепи и возвращаться к катоду, где происходит другая химическая реакция. Когда материал в катоде или аноде расходуется или больше не может использоваться в реакции, батарея не может производить электричество. В этот момент ваша батарея «умерла».
Батарейки, которые необходимо выбрасывать после использования, известны как первичные батареи . Батареи, которые можно перезаряжать, называются вторичными батареями .
Литий-полимерные батареи, например, можно перезаряжать
Без батарей ваш квадрокоптер должен быть привязан к стене, вам придется вручную заводить машину, а ваш контроллер Xbox должен быть подключен ко всем времени (как в старые добрые времена). Батареи предлагают способ хранения электрической потенциальной энергии в портативном контейнере.
Батарейки бывают разных форм, размеров и химического состава.
Изобретение современной батареи часто приписывают Алессандро Вольта. На самом деле все началось с удивительного происшествия, связанного с вскрытием лягушки.
На самом деле все началось с удивительного происшествия, связанного с вскрытием лягушки.
Чему вы научитесь
В этом руководстве будут подробно рассмотрены следующие темы:
- Как были изобретены батареи
- Из каких частей состоит батарея
- Как работает батарея
- Общие термины, используемые для описания батарей
- Различные способы использования батарей в цепях
Рекомендуемая литература
Есть несколько понятий, с которыми вы, возможно, захотите ознакомиться перед тем, как начать читать это руководство:
- Что такое электричество
- Напряжение, ток, сопротивление и закон Ома
- Что такое цепь
- Серийные и параллельные цепи
- Электроэнергия
- Переменный ток (AC) и постоянный ток (DC)
Хотите изучить различные аккумуляторы?
Мы вас прикроем!
Батарейка типа «таблетка» — 20 мм (CR2032)
В наличии ПРТ-00338
Избранное Любимый 32
Список желаний
Литий-ионный аккумулятор — 18650 ячеек (2600 мАч)
В наличии ПРТ-12895
Избранное Любимый 19
Список желаний
Литий-ионный аккумулятор — 400 мАч
В наличии ПРТ-13851
10
Избранное Любимый 40
Список желаний
Щелочная батарея 9В
В наличии ПРТ-10218
1
Избранное Любимый 6
Список желаний
Посмотреть все аккумуляторы
История
Термин «батарея»
Исторически слово «батарея» использовалось для описания «серии подобных объектов, сгруппированных вместе для выполнения определенной функции», как в артиллерийской батарее. В 1749 году Бенджамин Франклин впервые использовал этот термин для описания серии конденсаторов, которые он соединил вместе для своих экспериментов с электричеством. Позже этот термин будет использоваться для любых электрохимических элементов, соединенных вместе с целью обеспечения электроэнергии.
В 1749 году Бенджамин Франклин впервые использовал этот термин для описания серии конденсаторов, которые он соединил вместе для своих экспериментов с электричеством. Позже этот термин будет использоваться для любых электрохимических элементов, соединенных вместе с целью обеспечения электроэнергии.
(Изображение предоставлено Alvinrune из Wikimedia Commons)
Изобретение батареи
В один судьбоносный день в 1780 году итальянский физик, врач, биолог и философ Луиджи Гальвани препарировал лягушку, прикрепленную к латунному крючку. Когда он коснулся лягушачьей лапки железным скальпелем, та дернулась. Гальвани предположил, что энергия исходит от самой ноги, но его коллега-ученый Алессандро Вольта считал иначе.
Вольта предположил, что импульсы лапок лягушки на самом деле были вызваны различными металлами, пропитанными жидкостью. Он повторил эксперимент, используя ткань, смоченную в рассоле, вместо трупа лягушки, что привело к аналогичному напряжению. Вольта опубликовал свои выводы в 179 г.1, а затем в 1800 году создал первую батарею, вольтов столб.
Вольта опубликовал свои выводы в 179 г.1, а затем в 1800 году создал первую батарею, вольтов столб.
вольтов столб состоял из стопки цинковых и медных пластин, разделенных тканью, пропитанной рассолом
столб Вольта страдал от двух основных проблем: вес стека вызвало вытекание электролита из ткани, а особые химические свойства компонентов привели к очень короткому сроку службы (около часа). Следующие двести лет уйдут на совершенствование конструкции Вольты и решение этих проблем.
Исправление гальванической батареи
Уильям Круикшенк из Шотландии решил проблему утечки, положив гальваническую батарею на бок, чтобы сформировать «желобную батарею».
Лотковая батарея решила проблему утечки гальванической батареи
Вторая проблема, короткий срок службы, была вызвана разложением цинка из-за примесей и образованием пузырьков водорода на меди. В 1835 году Уильям Стерджен обнаружил, что обработка цинка ртутью предотвращает деградацию.
Британский химик Джон Фредерик Дэниелл использовал второй электролит, который реагировал с водородом, предотвращая отложения на медном катоде. Двухэлектролитная батарея Даниэля, известная как «ячейка Даниэля», станет очень популярным решением для обеспечения энергией зарождающихся телеграфных сетей.
Коллекция элементов Даниэля 1836 года
Первая перезаряжаемая батарея
В 1859 году французский физик Гастон Планте создал батарею из двух скрученных листов свинца, погруженных в серную кислоту. При реверсировании электрического тока через батарею химический состав вернется в исходное состояние, создав таким образом первую перезаряжаемую батарею.
Позже, в 1881 году, Камилла Альфонс Фор улучшила конструкцию Планте, превратив свинцовые листы в пластины. Эта новая конструкция упростила производство аккумуляторов, и свинцово-кислотные аккумуляторы получили широкое распространение в автомобилях.
-> Дизайн обычного «автомобильного аккумулятора» существует уже более 100 лет. 1800-х годов электролит в батареях находился в жидком состоянии. Это делало транспортировку батарей очень осторожным делом, и большинство батарей никогда не предназначалось для перемещения после подключения к цепи.
1800-х годов электролит в батареях находился в жидком состоянии. Это делало транспортировку батарей очень осторожным делом, и большинство батарей никогда не предназначалось для перемещения после подключения к цепи.
В 1866 году Жорж Лекланше создал батарею, используя цинковый анод, катод из диоксида марганца и раствор хлорида аммония в качестве электролита. В то время как электролит в элементе Лекланше все еще был жидким, химический состав батареи оказался важным шагом на пути к изобретению сухого элемента.
Карл Гасснер придумал, как создать электролитную пасту из хлорида аммония и гипса. Он запатентовал новую «сухую» батарею в 1886 году в Германии.
Эти новые сухие элементы, обычно называемые «цинково-угольными батареями», производились массово и пользовались огромной популярностью до конца 1950-х годов. Хотя углерод не используется в химической реакции, он выполняет важную роль электрического проводника в угольно-цинковой батарее.
-> 3-вольтовая угольно-цинковая батарея 1960-х годов
(Изображение предоставлено PhFabre из Wikimedia Commons) <-
известный как «Eveready», а затем «Energizer») заменил электролит хлорида аммония щелочным веществом на основе химии батареи, сформулированной Вальдемаром Юнгнером в 189 г. 9. Сухие щелочные батареи могут удерживать больше энергии, чем угольно-цинковые батареи того же размера, и имеют более длительный срок хранения.
9. Сухие щелочные батареи могут удерживать больше энергии, чем угольно-цинковые батареи того же размера, и имеют более длительный срок хранения.
Популярность щелочных батарей возросла в 1960-х годах, они обогнали угольно-цинковые батареи и с тех пор стали стандартными первичными элементами для потребительского использования.
-> Щелочные батареи бывают разных форм и размеров
(Изображение предоставлено Aney~commonswiki из Викисклада) <-
Перезаряжаемые батареи 20-го века
В 1970-х годах компания COMSAT разработала никель-водородную батарею для использования в спутниках связи. Эти батареи хранят водород в газообразной форме под давлением. Многие искусственные спутники, такие как Международная космическая станция, по-прежнему используют никель-водородные батареи.
Исследования нескольких компаний с конца 1960-х годов привели к созданию никель-металлогидридной (NiMH) батареи. NiMH аккумуляторы были выпущены на потребительский рынок в 1989 году и стали более дешевой альтернативой перезаряжаемым никель-водородным элементам.
Компания Asahi Chemical из Японии создала первую литий-ионную батарею в 1985 году, а Sony создала первую коммерческую литий-ионную батарею в 1991 году. «литий-полимерный» или «LiPo» аккумулятор.
Химические реакции в литий-полимерном аккумуляторе в основном такие же, как и в литий-ионном аккумуляторе
Очевидно, что было изобретено, произведено и устарело намного больше химических элементов аккумуляторов. Если вы хотите узнать больше о современных и популярных технологиях аккумуляторов, ознакомьтесь с нашим руководством по технологиям аккумуляторов.
Компоненты
Аккумуляторы состоят из трех основных компонентов: анода , катода и электролита . Сепаратор часто используется для предотвращения соприкосновения анода и катода, если электролита недостаточно. Для хранения этих компонентов аккумуляторы обычно имеют какой-нибудь кожух .
Хорошо, большинство батарей на самом деле не разделены на три равные секции, но вы поняли идею. Лучшее поперечное сечение щелочной ячейки можно найти в Википедии.
Лучшее поперечное сечение щелочной ячейки можно найти в Википедии.
Анод и катод относятся к типам электродов . Электроды — это проводники, по которым электричество входит или выходит из компонента в цепи.
Анод
Электроны вытекают из анода в устройстве, подключенном к цепи. Это означает, что обычный «ток» течет в анод.
На батареях анод помечен как отрицательная (-) клемма
В батарее химическая реакция между анодом и электролитом вызывает накопление электронов на аноде. Эти электроны хотят двигаться к катоду, но не могут пройти через электролит или сепаратор.
Катод
Электроны текут в катод в устройстве, подключенном к цепи. Это означает, что обычный «ток» течет из катода.
На батареях катод отмечен как положительная (+) клемма
В батареях химическая реакция внутри или вокруг катода использует электроны, произведенные в аноде. Единственный способ для электронов добраться до катода — через цепь, внешнюю по отношению к батарее.
Единственный способ для электронов добраться до катода — через цепь, внешнюю по отношению к батарее.
Электролит
Электролит – это вещество, часто жидкое или гелеобразное, способное переносить ионы между химическими реакциями, протекающими на аноде и катоде. Электролит также препятствует потоку электронов между анодом и катодом, так что электроны легче проходят через внешнюю цепь, а не через электролит.
-> Щелочные батареи могут вытекать из электролита, гидроксида калия, при воздействии сильного нагрева или обратного напряжения
(Изображение предоставлено Вильямом Дэвисом из Wikimedia Commons) <-
Электролит играет решающую роль в работе аккумулятора. Поскольку электроны не могут пройти через него, они вынуждены путешествовать по электрическим проводникам в виде цепи, соединяющей анод с катодом.
Сепаратор
Сепараторы представляют собой пористые материалы, препятствующие соприкосновению анода и катода, которое могло бы вызвать короткое замыкание в батарее.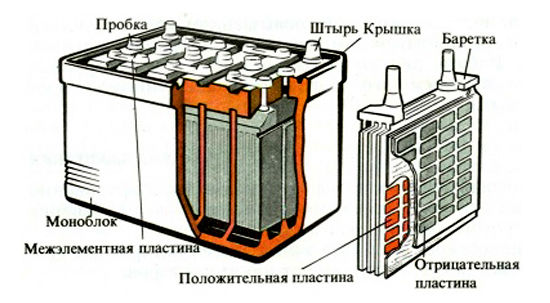 Сепараторы могут быть изготовлены из различных материалов, включая хлопок, нейлон, полиэстер, картон и синтетические полимерные пленки. Сепараторы химически не реагируют ни с анодом, ни с катодом, ни с электролитом.
Сепараторы могут быть изготовлены из различных материалов, включая хлопок, нейлон, полиэстер, картон и синтетические полимерные пленки. Сепараторы химически не реагируют ни с анодом, ни с катодом, ни с электролитом.
В гальваническом столбе используется ткань или картон (разделитель), пропитанные солевым раствором (электролитом), чтобы держать электроды разделенными.
Ионы в электролите могут быть положительно заряжены, отрицательно заряжены и могут быть разных размеров. Могут быть изготовлены специальные сепараторы, которые пропускают одни ионы, но не пропускают другие.
Корпус
Большинству аккумуляторов требуется способ содержания их химических компонентов. Корпуса, также известные как «корпуса» или «оболочки», представляют собой просто механические конструкции, предназначенные для удержания внутренних частей батареи.
Этот свинцово-кислотный аккумулятор имеет пластиковый корпус
Корпуса аккумуляторов могут быть изготовлены практически из чего угодно: пластика, стали, пакетов из мягкого полимерного ламината и т. д. В некоторых батареях используется проводящий стальной корпус, электрически соединенный с одним из электродов. В случае обычного щелочного элемента АА стальной корпус соединен с катодом.
д. В некоторых батареях используется проводящий стальной корпус, электрически соединенный с одним из электродов. В случае обычного щелочного элемента АА стальной корпус соединен с катодом.
Эксплуатация
Для работы аккумуляторов обычно требуется несколько химических реакций. По крайней мере, одна реакция происходит на аноде или вокруг него, и одна или несколько реакций происходят на катоде или вокруг него. Во всех случаях реакция на аноде производит дополнительные электроны в процессе, называемом окисление , а реакция на катоде использует дополнительные электроны во время процесса, известного как восстановление .
Когда переключатель замкнут, цепь замыкается, и электроны могут течь от анода к катоду. Эти электроны обеспечивают химические реакции на аноде и катоде.
По сути, мы разделяем определенный вид химической реакции, реакцию восстановления-окисления или окислительно-восстановительную реакцию, на две отдельные части.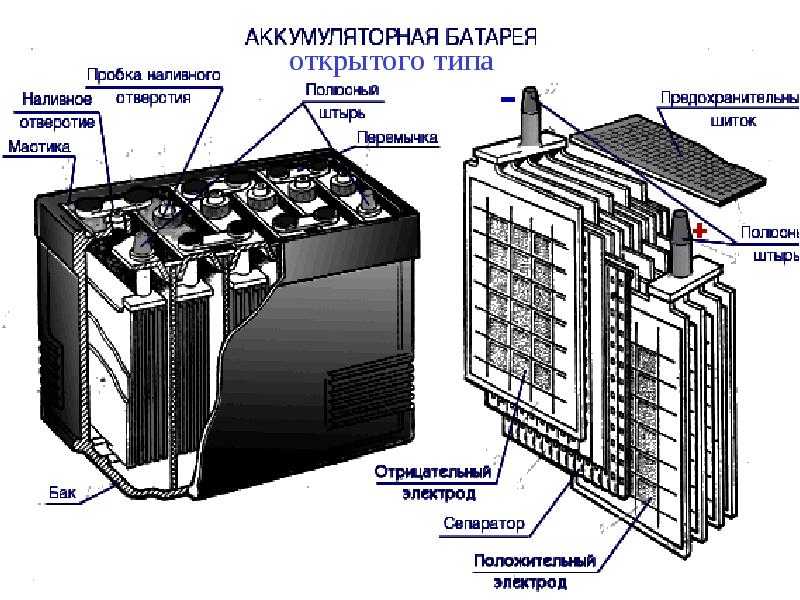 Окислительно-восстановительные реакции происходят, когда электроны переносятся между химическими веществами. Мы можем использовать движение электронов в этой реакции, чтобы течь за пределы батареи, чтобы питать нашу цепь.
Окислительно-восстановительные реакции происходят, когда электроны переносятся между химическими веществами. Мы можем использовать движение электронов в этой реакции, чтобы течь за пределы батареи, чтобы питать нашу цепь.
Окисление анода
Эта первая часть окислительно-восстановительной реакции, окисление, происходит между анодом и электролитом и производит электроны (обозначены как e — ).
В некоторых реакциях окисления образуются ионы, например, в литий-ионном аккумуляторе. В других химических реакциях расходуются ионы, как в обычной щелочной батарее. В любом случае ионы могут свободно проходить через электролит, а электроны — нет.
Катодное восстановление
Другая половина окислительно-восстановительной реакции, восстановление, происходит на катоде или рядом с ним. Электроны, образующиеся в результате реакции окисления, расходуются при восстановлении.
В некоторых случаях, например, в литий-ионных батареях, положительно заряженные ионы лития, образующиеся в ходе реакции окисления, расходуются во время восстановления.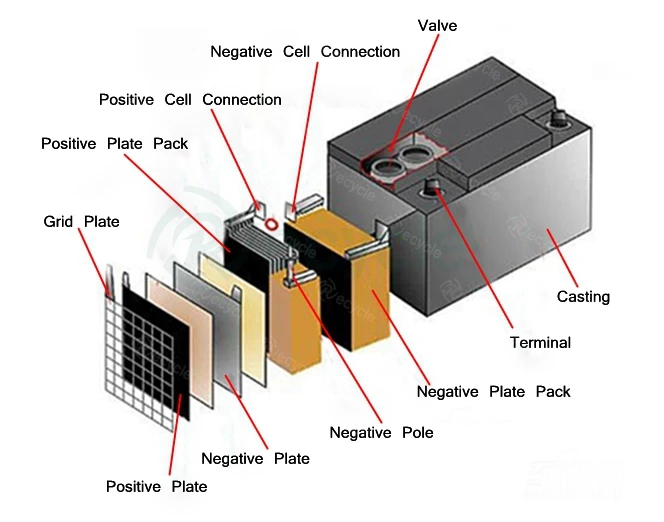 В других случаях, например, в щелочных батареях, при восстановлении образуются отрицательно заряженные ионы.
В других случаях, например, в щелочных батареях, при восстановлении образуются отрицательно заряженные ионы.
Электронный поток
В большинстве батарей некоторые или все химические реакции могут происходить, даже если батарея не подключена к цепи. Эти реакции могут повлиять на срок годности батареи.
По большей части реакции будут происходить в полную силу только тогда, когда между анодом и катодом замкнута электропроводящая цепь. Чем меньше сопротивление между анодом и катодом, тем больше электронов может протекать и тем быстрее происходят химические реакции.
Создание короткого замыкания в аккумуляторе (в данном случае даже случайного) может быть опасным. Известно, что литий-ионные батареи перегреваются и даже дымят или загораются при наличии короткого замыкания.
Мы можем пропустить эти движущиеся электроны через различные электрические компоненты, известные как «нагрузка», чтобы сделать что-то полезное. На моушн-графике в начале этого раздела мы зажигаем виртуальную лампочку нашими движущимися электронами.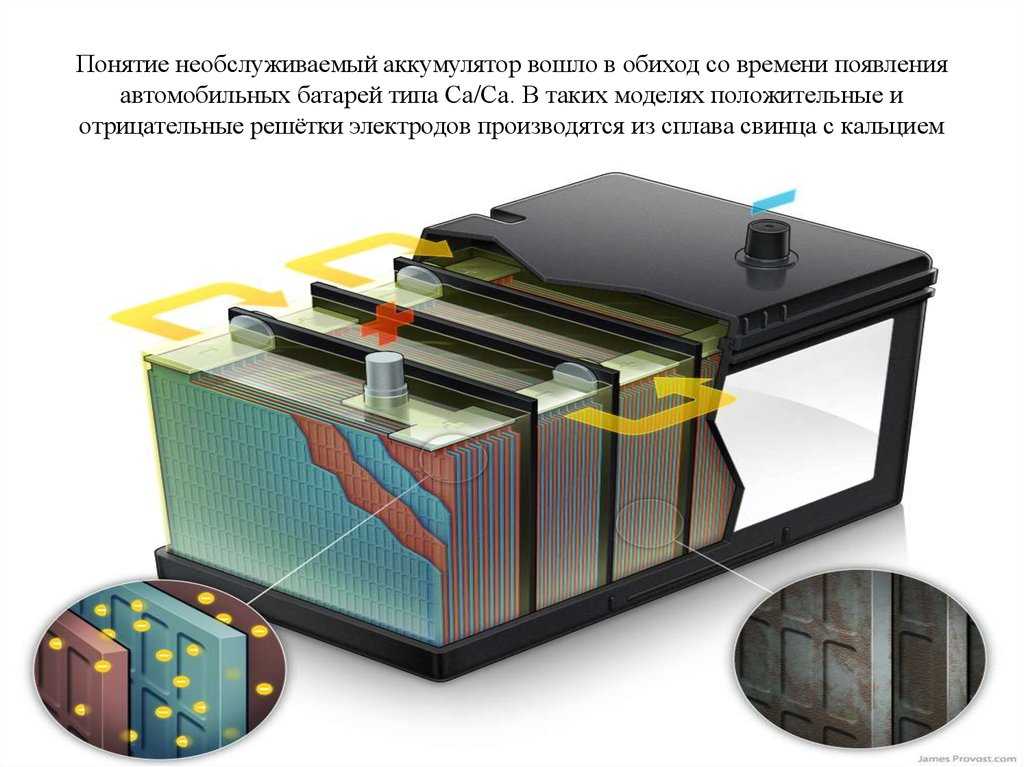
Разряженный аккумулятор
Химические вещества в аккумуляторе в конце концов достигнут состояния равновесия. В этом состоянии химические вещества больше не будут реагировать, и в результате батарея больше не будет генерировать электрический ток. В этот момент аккумулятор считается «разряженным».
Первичные элементы должны быть утилизированы, когда батарея разряжена. Вторичные элементы можно перезаряжать, и это достигается путем подачи обратного электрического тока через батарею. Перезарядка происходит, когда химические вещества выполняют еще одну серию реакций, чтобы вернуть их в исходное состояние.
Терминология
Люди часто используют общий набор терминов, когда говорят о напряжении батареи, емкости, возможности источника тока и так далее.
Ячейка
Ячейка относится к одному аноду и катоду, разделенным электролитом, используемым для получения напряжения и тока. Аккумулятор может состоять из одной или нескольких ячеек. Например, одна батарея типа АА представляет собой одну ячейку.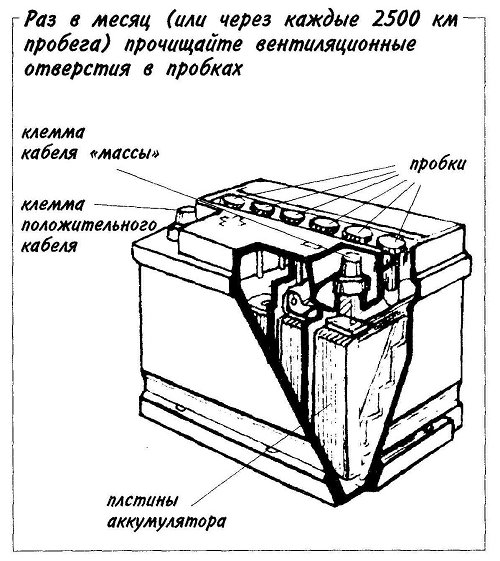 Автомобильные аккумуляторы содержат шесть ячеек по 2,1 В каждая.
Автомобильные аккумуляторы содержат шесть ячеек по 2,1 В каждая.
Обычная 9-вольтовая батарея состоит из шести щелочных элементов 1,5 В, установленных друг над другом
Первичные
Первичные клетки содержат химию, которую нельзя обратить. В результате батарея должна быть выброшена после того, как она мертва.
Вторичные
Вторичные элементы можно перезарядить, и их химический состав вернется в исходное состояние. Эти элементы, также известные как «перезаряжаемые батареи», можно использовать много раз.
Номинальное напряжение
Номинальное напряжение батареи — это напряжение, указанное производителем.
Например, щелочные батареи AA указаны как имеющие напряжение 1,5 В. В этой статье от Mad Scientist Hut показано, что их протестированные щелочные батареи начинаются с напряжения около 1,55 В, а затем постепенно теряют напряжение по мере разрядки. В этом примере номинальное напряжение «1,5 В» относится к максимальному или начальному напряжению батареи.
Этот аккумуляторный блок Storm для квадрокоптеров показывает кривую разрядки их LiPo элементов, начиная с 4,2 В и падая примерно до 2,8 В по мере разрядки. Номинальное напряжение, указанное для большинства литий-ионных и LiPo элементов, составляет 3,7 В. В этом случае номинальное напряжение «3,7 В» относится к среднему напряжению батареи в течение цикла ее разрядки.
Емкость
Емкость батареи — это мера количества электрического заряда, который она может отдать при определенном напряжении. Большинство аккумуляторов рассчитаны на ампер-часы (Ач) или миллиампер-часы (мАч).
Этот аккумулятор LiPo рассчитан на 1000 мАч, что означает, что он может обеспечить 1 ампер в течение 1 часа, прежде чем он будет считаться разряженным.
Большинство графиков разряда батареи показывают напряжение батареи в зависимости от емкости, например, эти тесты батареи AA от PowerStream. Чтобы выяснить, достаточно ли емкости аккумулятора для питания вашей схемы, найдите минимальное допустимое напряжение и найдите соответствующее значение в мАч или Ач.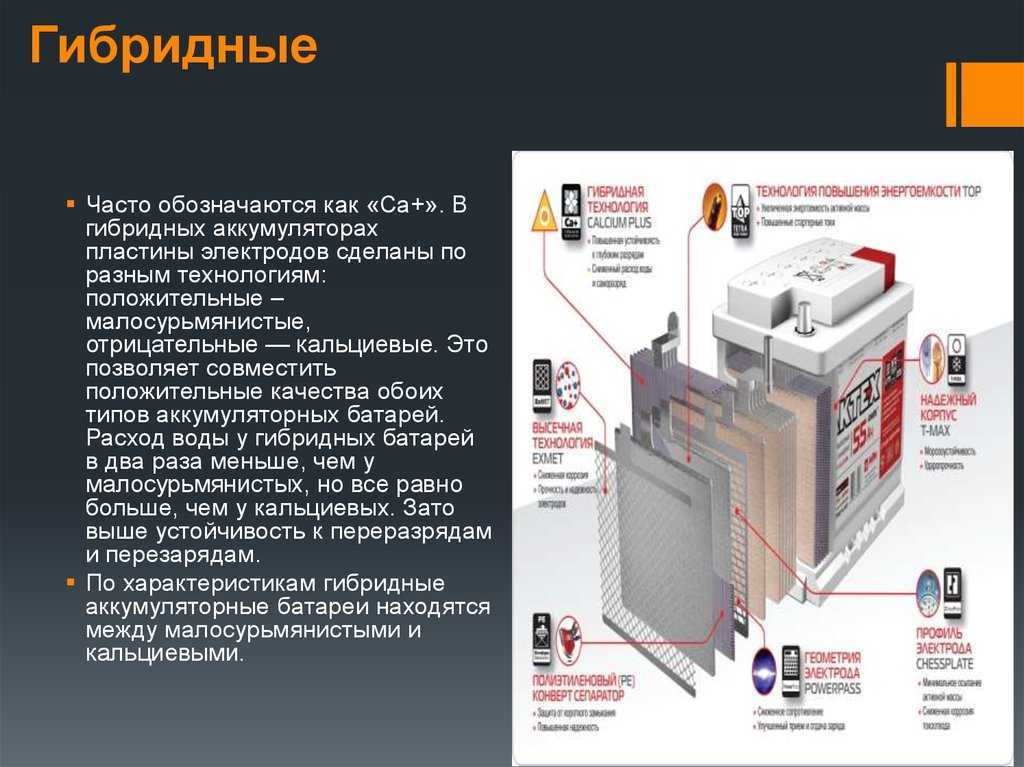
C-Rate
Многие аккумуляторы, особенно мощные литий-ионные батареи, обозначают ток разряда как C-Rate, чтобы более четко определить атрибуты батареи. C-Rate — это скорость разряда относительно максимальной емкости аккумулятора.
1C — это величина тока, необходимая для разрядки аккумулятора за 1 час. Например, батарея емкостью 400 мАч, обеспечивающая ток 1С, будет обеспечивать 400 мА. 5C для той же батареи будет 2 A.
Большинство батарей теряют емкость при более высоком потреблении тока. Например, этот информационный график продукта от Chargery показывает, что их аккумулятор LiPo имеет меньшую емкость мАч при более высоких показателях C-Rate.
ПРИМЕЧАНИЕ: Общий совет гласит, что вы должны заряжать аккумуляторы LiPo при температуре 1С или меньше.
Массачусетский технологический институт разработал фантастическое руководство по спецификациям аккумуляторов и терминологии, которое идет гораздо дальше этого обзора.
Применение
Одноэлементный
Некоторые схемы могут питаться от одного элемента, но убедитесь, что батарея может обеспечивать достаточное напряжение и ток.
Этот Photon Battery Shield питается от одного элемента LiPo
Если напряжение слишком высокое или слишком низкое для вашей схемы, вам, вероятно, понадобится преобразователь постоянного тока в постоянный.
9Серия 0032Чтобы увеличить напряжение между клеммами батареи, вы можете расположить элементы последовательно. Серия означает укладку элементов встык, соединяя анод одного с катодом следующего.
Соединяя аккумуляторы последовательно, вы увеличиваете общее напряжение. Добавьте напряжение всех ячеек, чтобы определить рабочее напряжение. Емкость остается прежней.
В этом примере последовательно соединены четыре элемента по 1,5 В. Напряжение на нагрузке составляет 6 В, а общий комплект аккумуляторов имеет емкость 2000 мАч.
В большинстве устройств бытовой электроники, в которых используются щелочные батареи, батареи устанавливаются последовательно. Например, этот держатель для двух батарей типа АА может повысить номинальное напряжение до 3 В для проекта.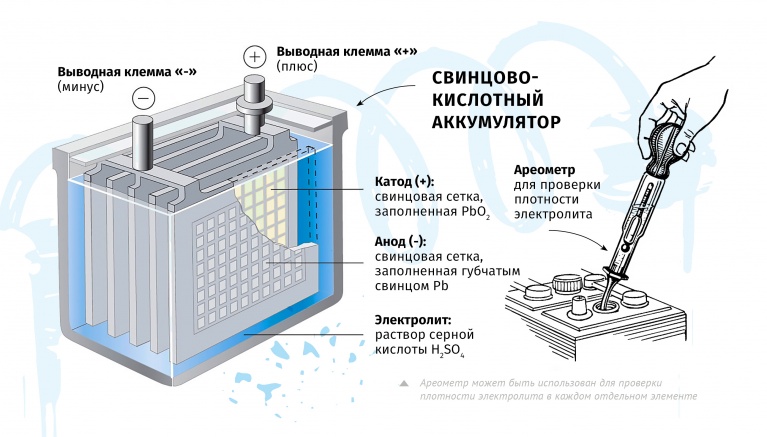
ПРИМЕЧАНИЕ: Если вы заряжаете литий-ионные или LiPo аккумуляторы последовательно, вам необходимо обязательно использовать специальную схему, известную как «балансир», чтобы обеспечить постоянное напряжение между элементами. Некоторые зарядные устройства, такие как это, имеют балансиры для безопасной зарядки.
Параллельный
Если напряжения одного элемента достаточно для нагрузки, вы можете добавить батареи параллельно, чтобы увеличить емкость. Обратите внимание, что это также означает увеличение доступного тока (C-Rate).
Будьте осторожны при параллельном соединении батарей! Все элементы должны иметь одинаковое номинальное напряжение и одинаковый уровень заряда. Если есть какие-либо перепады напряжения, может произойти короткое замыкание, что приведет к перегреву и возгоранию.
В этом примере четыре элемента по 1,5 В соединены параллельно. Напряжение на нагрузке остается на уровне 1,5 В, но общая емкость увеличивается до 8000 мАч.
Серийные и параллельные батареи
Если вы хотите увеличить напряжение и емкость, вы можете комбинировать последовательные и параллельные батареи. Еще раз убедитесь, что уровень напряжения для батарей, включенных параллельно, одинаков, так как может произойти короткое замыкание.
В этом примере общее напряжение на нагрузке составляет 3 В, а общая емкость аккумуляторов составляет 4000 мАч.
В больших аккумуляторных блоках, особенно литий-ионных, вы часто видите конфигурацию, указанную с использованием «S» и «P» для последовательного и параллельного подключения. Конфигурация схемы выше — 2S2P. В качестве практического примера современные электромобили используют массивные батареи, соединенные последовательно и параллельно.
Ресурсы и дальнейшее развитие
К этому моменту вы уже должны понимать, как были изобретены батареи и как они работают. Батареи — это один из способов обеспечения электроэнергией вашего проекта, и они могут быть невероятно полезны, если вам нужен портативный источник питания.
Если вы хотите узнать больше об аккумуляторах, вот еще несколько руководств:
- Battery Technologies
- Как включить проект
- Что такое цепь?
Хотите увидеть батареи в действии? Взгляните на эти проекты, в которых используются разные батареи в разных конфигурациях:
Беспроводная связь Саймона Сплозиона
Это туториал, демонстрирующий одну из многих техник «взлома» Саймона Говорит. Мы расскажем, как взять ваш Simon Says Wireless.
Избранное Любимый 3
Базовая дифференциальная платформа Actobotics
Начните работу с Actobotics с помощью этого простого транспортного средства. Затем расширьте и настройте его для своей собственной империи злых роботов.
Избранное Любимый 7
Всплывающая плата со светодиодной бабочкой
Создайте светящуюся всплывающую карту бабочки с медной лентой, двумя светодиодами и батареей.
Избранное Любимый 8
Дистанционный фотонный датчик температуры
Узнайте, как построить собственную станцию для измерения температуры на солнечных батареях с подключением к Интернету, используя Photon from Particle.
Избранное Любимый 11
ESP8266 Пылесос на пропане
Узнайте, как Ник Пул построил огневую пушку, управляемую через WiFi, с помощью платы ESP8266 Thing Dev!
Избранное Любимый 4
Сигнализация стиральной/сушильной машины Blynk Board
Как настроить Blynk Board и приложение, чтобы уведомлять вас, когда ваша стиральная машина или сушилка перестали трястись.
Избранное Любимый 9
DOE поясняет.
 ..Батарейки | Министерство энергетики
..Батарейки | Министерство энергетикиОфис Наука
Аккумуляторы и аналогичные устройства принимают, хранят и выдают электроэнергию по требованию. Батареи используют химию в форме химического потенциала для хранения энергии, как и многие другие повседневные источники энергии. Например, бревна хранят энергию в своих химических связях до тех пор, пока горение не преобразует энергию в тепло. Бензин накапливает химическую потенциальную энергию до тех пор, пока она не преобразуется в механическую энергию в двигателе автомобиля. Точно так же, чтобы батареи работали, электричество должно быть преобразовано в форму химического потенциала, прежде чем его можно будет легко хранить. Батареи состоят из двух электрических выводов, называемых катодом и анодом, разделенных химическим материалом, называемым электролитом. Для приема и высвобождения энергии батарея подключается к внешней цепи. Электроны движутся по цепи, в то время как ионы (атомы или молекулы с электрическим зарядом) движутся по электролиту. В перезаряжаемой батарее электроны и ионы могут двигаться в любом направлении по цепи и электролиту. Когда электроны движутся от катода к аноду, они увеличивают химическую потенциальную энергию, тем самым заряжая батарею; когда они движутся в другом направлении, они преобразуют эту химическую потенциальную энергию в электричество в цепи и разряжают батарею. Во время зарядки или разрядки противоположно заряженные ионы перемещаются внутри батареи через электролит, чтобы сбалансировать заряд электронов, движущихся по внешней цепи, и создать устойчивую перезаряжаемую систему. После зарядки батарею можно отключить от цепи, чтобы сохранить химическую потенциальную энергию для последующего использования в качестве электричества.
В перезаряжаемой батарее электроны и ионы могут двигаться в любом направлении по цепи и электролиту. Когда электроны движутся от катода к аноду, они увеличивают химическую потенциальную энергию, тем самым заряжая батарею; когда они движутся в другом направлении, они преобразуют эту химическую потенциальную энергию в электричество в цепи и разряжают батарею. Во время зарядки или разрядки противоположно заряженные ионы перемещаются внутри батареи через электролит, чтобы сбалансировать заряд электронов, движущихся по внешней цепи, и создать устойчивую перезаряжаемую систему. После зарядки батарею можно отключить от цепи, чтобы сохранить химическую потенциальную энергию для последующего использования в качестве электричества.
Батарейки были изобретены в 1800 году, но их химические процессы сложны. Ученые используют новые инструменты, чтобы лучше понять электрические и химические процессы в батареях, чтобы создать новое поколение высокоэффективных накопителей электроэнергии. Например, они разрабатывают улучшенные материалы для анодов, катодов и электролитов в батареях.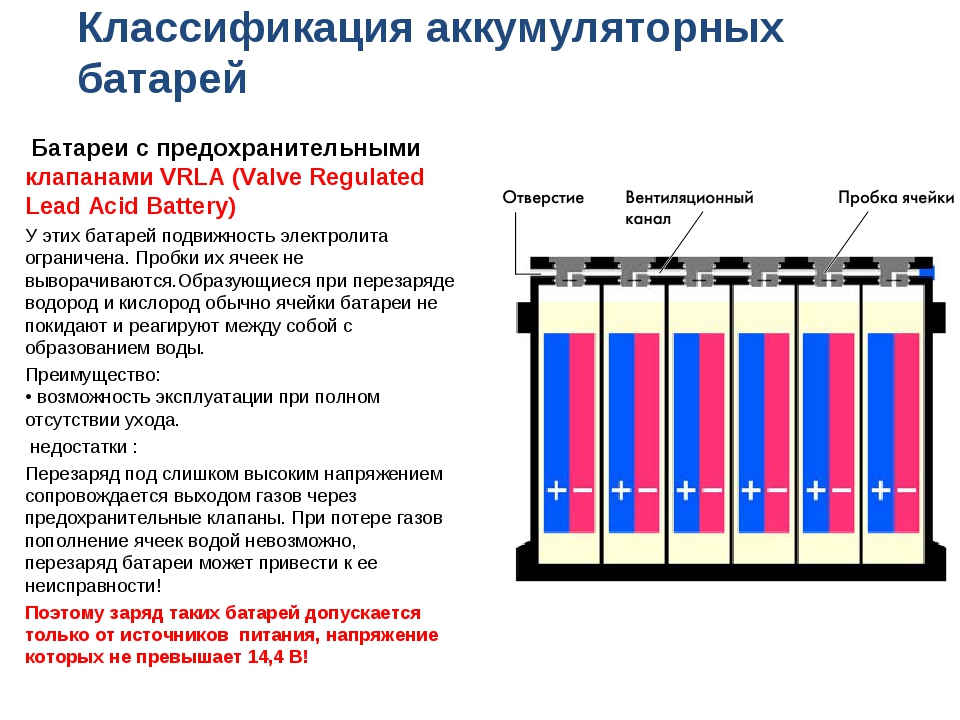 Ученые изучают процессы в перезаряжаемых батареях, потому что они не полностью меняются местами при зарядке и разрядке батареи. Со временем отсутствие полного реверсирования может изменить химический состав и структуру материалов батареи, что может снизить производительность и безопасность батареи.
Ученые изучают процессы в перезаряжаемых батареях, потому что они не полностью меняются местами при зарядке и разрядке батареи. Со временем отсутствие полного реверсирования может изменить химический состав и структуру материалов батареи, что может снизить производительность и безопасность батареи.
Управление науки и хранения электроэнергии Министерства энергетики США
Исследования, проведенные при поддержке Управления науки Министерства энергетики и Управления фундаментальных наук об энергетике (BES), привели к значительным улучшениям в области хранения электроэнергии. Но мы все еще далеки от комплексных решений для хранения энергии следующего поколения с использованием совершенно новых материалов, которые могут значительно увеличить количество энергии, которое может хранить батарея. Это хранилище имеет решающее значение для интеграции возобновляемых источников энергии в наше электроснабжение. Поскольку совершенствование аккумуляторных технологий необходимо для широкого использования подключаемых к сети электромобилей, хранение также является ключом к снижению нашей зависимости от нефти в качестве транспорта.
BES поддерживает исследования отдельных ученых и междисциплинарных центров. Крупнейшим центром является Объединенный центр исследований в области хранения энергии (JCESR), центр инноваций в области энергетики Министерства энергетики. Этот центр изучает электрохимические материалы и явления на атомном и молекулярном уровне и использует компьютеры для разработки новых материалов. Это новое знание позволит ученым разработать более безопасное хранилище энергии, которое прослужит дольше, быстрее заряжается и имеет большую емкость. По мере того, как ученые, поддерживаемые программой BES, добиваются новых успехов в науке об аккумуляторах, эти достижения используются прикладными исследователями и промышленностью для улучшения приложений в области транспорта, электросетей, связи и безопасности.
Факты о хранении электроэнергии
- Нобелевская премия по химии 2019 года была присуждена совместно Джону Б. Гуденафу, М. Стэнли Уиттингему и Акире Йошино «за разработку литий-ионных аккумуляторов».

- Электролитный геном в JCESR создал вычислительную базу данных с более чем 26 000 молекул, которые можно использовать для расчета основных свойств электролита для новых усовершенствованных аккумуляторов.
Ресурсы и родственные термины
- Потребности в фундаментальных исследованиях для хранения электроэнергии следующего поколения Проект материалов
- и геном электролита
- Скрытая архитектура накопителя энергии
- Заглядывая в аккумуляторы: рентгеновские лучи раскрывают тайны литий-ионных аккумуляторов
- Активизация разработки литий-ионных аккумуляторов
- Научное открытие: двоюродный брат поваренной соли может сделать накопление энергии более быстрым и безопасным
Научные термины могут сбивать с толку. Объяснения DOE предлагают простые объяснения ключевых слов и понятий в фундаментальной науке. В нем также описывается, как эти концепции применяются к работе, которую проводит Управление науки Министерства энергетики, помогая Соединенным Штатам преуспеть в исследованиях по всему научному спектру.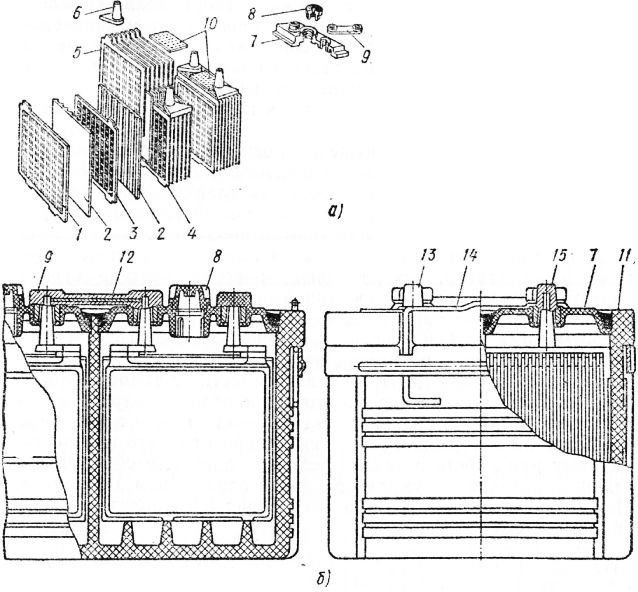
Restaurants and Dining — BatteryATL
diamondВ The Battery Atlanta™ есть стол на любой вкус, в котором представлены старые любимые блюда и новые уникальные концепции от самых популярных рестораторов Атланты, таких как иконы Форд Фрай и Линтон Хопкинс. Хочешь выпить перед игрой? В наших ресторанах представлено пиво, вино и напитки со всего мира.
43
алмазYard House
Yard House предлагает меню из более чем 100 блюд в американском стиле, которые ежедневно готовятся с нуля, обширное меню крафтовых коктейлей и самый большой в мире выбор разливного пива.
посетите сайт
50
алмазGarden & Gun Club
Этот первоклассный ресторан воплощает в жизнь определяющий южный стиль жизни с тщательно подобранным меню изысканных коктейлей и современной интерпретацией некоторых из наших любимых классических южных блюд.
посетите сайт
12
бриллиантМороженое Jeni’s Splendid
Мороженое Jeni’s Splendid представляет собой смесь обычного мороженого с вдохновляющими вкусами.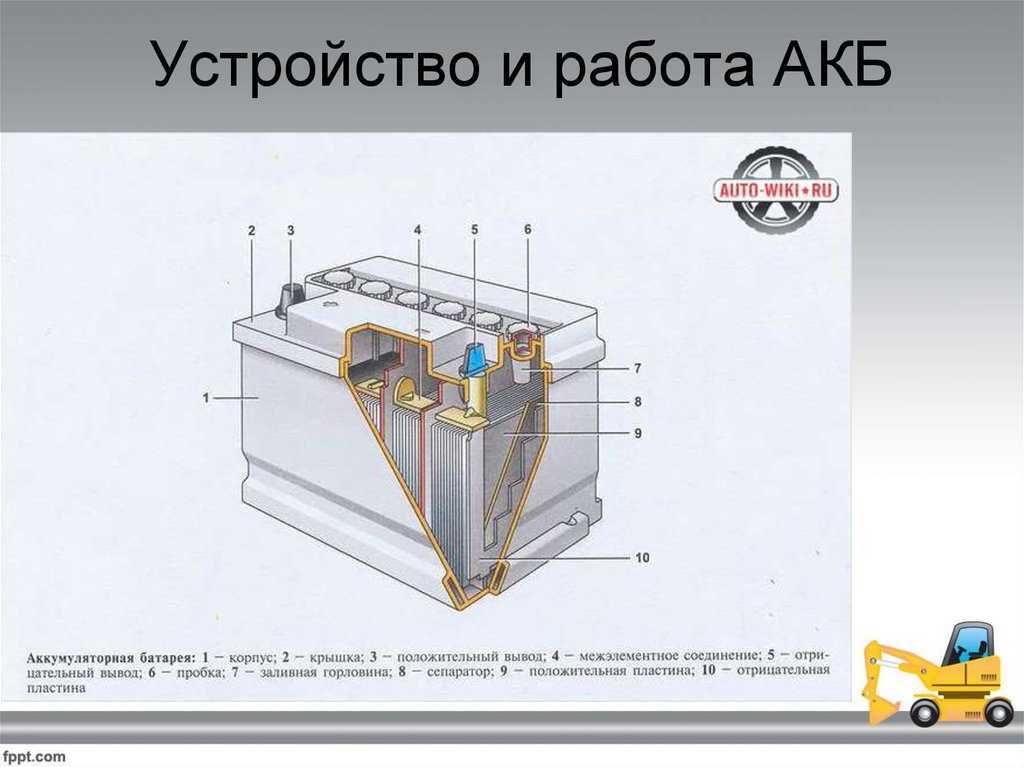 Jeni’s стремится делать лучшее мороженое и объединять людей.
Jeni’s стремится делать лучшее мороженое и объединять людей.
посетите сайт
31
алмазBURN by Rocky Patel
BURN by Rocky Patel, расположенный в Battery Atlanta, представляет собой эволюцию сигарных салонов. Burn — это прибежище для тех, кто любит изысканные сигары и спиртные напитки премиум-класса.
посетите сайт
32
бриллиантWahlburgers
Меню, вдохновленное шеф-поваром, и бар с полным спектром услуг — это популярное место встречи, предлагающее разнообразные свежие гамбургеры, домашние приправы и впечатляющий выбор фирменных напитков.
посетить сайт
11
алмазИрландский паб Mac McGee
Любимый фанатами местный паб Mac Mcgee предлагает изысканные варианты традиционной ирландской классики, в том числе сосиски и пюре, рыбу с жареным картофелем и пастуший пирог.
посетите сайт
33
скоро
алмазCultivate Food & Coffee
Cultivate — это передовая концепция позднего завтрака и кофе, основанная на кулинарных принципах «свежие с нуля» от фермы до стола, поистине мирового класса. обслуживание клиентов и эстетически положительный опыт для всех клиентов. #культивироватьдоброту
обслуживание клиентов и эстетически положительный опыт для всех клиентов. #культивироватьдоброту
посетить сайт
35
алмазВинный бар Cru
Винный бар Cru Food & Wine Bar предлагает все, начиная от вкусных и общих блюд, пиццы, приготовленной на камне, уникальных вин, больших тарелок и сырных досок ручной работы.
посетить сайт
51
алмазC. Ellet’s Steakhouse
C. Ellet’s — это современный стейк-хаус, предлагающий два вида обеда либо в клубном зале, либо в главном обеденном зале.
посетите сайт
36
алмазХорошая игра на базе Topgolf Swing Suite
Хорошая игра — на базе Topgolf Swing Suite — это захватывающий опыт, в котором вы можете есть, пить и играть, используя новейшие технологии виртуальных игр Topgolf.
посетите сайт
41
алмазЖИВОЙ! Спорт и общение
посетите сайт
25
алмазEATaliano Kitchen
EATaliano Kitchen предлагает широкий выбор пиццы, итальянских закусок и вина. Пункты меню включают салат капрезе, овощные панини, сырные равиоли, лингвини из морепродуктов и многое другое.
Пункты меню включают салат капрезе, овощные панини, сырные равиоли, лингвини из морепродуктов и многое другое.
посетите сайт
62
алмазH&F Burger
Болельщики могут попасть в ресторан изнутри Truist Park в дни игр, в то время как другие гости могут зайти через двери на лужайке со стороны The Battery Atlanta. H&F открыт только на игровые дни.
посетите сайт
38
алмазGoldbergs Fine Foods
Goldbergs Fine Foods известен широким ассортиментом нью-йоркских деликатесов, таких как сэндвичи Reuben, свежие рогалики, суп с шариками мацы и ассортимент тарелок.
посетите сайт
19
скоро
алмазBattle & Brew
Лучшие социальные игры во всей Атланте скоро откроются в The Battery Atlanta. Battle & Brew позволяет гостям сидеть бок о бок с друзьями, играя в лучшие игры, которые могут предложить Nintendo, PlayStation, Xbox, ПК или настольные игры. Ресторан Battle & Brew, который откроется в начале 2023 года, может похвастаться обширным меню блюд и алкогольных напитков.
Ресторан Battle & Brew, который откроется в начале 2023 года, может похвастаться обширным меню блюд и алкогольных напитков.
посетить сайт
20
алмазPh’east
Отправляйтесь в PH’EAST на Far East Street Feast с творческими, но аутентичными азиатскими торговцами едой. PH’EAST предлагает шесть вариантов поставщиков для вашего следующего приема пищи.
посетить сайт
37
алмазЧаша для пунша Social
Чаша для пунша Social сочетает в себе приготовление еды в стиле закусочной, напитки ручной работы и классические развлечения в стиле салона.
посетить сайт
44
алмазEl Super Pan
Оживленный сэндвич-бар со смелыми вкусами от пуэрториканского шеф-повара Гектора Сантьяго, включающий новаторский подход к классической латиноамериканской выпечке.
посетить сайт
48
алмазSuperica
Здесь подают вкусные блюда мексиканской и американской кухни, а также демонстрируются подлинные изделия ручной работы.
посетите сайт
59
алмазTerrapin Taproom и барбекю Fox Bros.
Поклонники афинской пивоварни могут насладиться постоянно меняющимся списком фирменных сортов пива, а также всемирно известным Fox Bros. Bar-B-Q.
посетите сайт
49
алмазAntico Pizza
Собственная Antico Pizza Napoletana сети The Battery Atlanta отмечена многочисленными СМИ, включая Atlanta Journal-Constitution, Trip Advisor, Eater, Food Network и The Guardian.
посетите сайт
Каталог магазинов
The Battery Atlanta ™ , многофункциональный комплекс площадью 2,25 миллиона квадратных футов, расположенный на пересечении I-75 и I-285, предлагает непревзойденное сочетание бутиков, рынка — эксклюзивные развлечения, рестораны с шеф-поварами, отели Omni и Aloft, The Coca-Cola Roxy и 531 резиденция. В комплекс входят офисы One Ballpark Center, региональная штаб-квартира Comcast; Two Ballpark Center, где проживает SPACES; Three Ballpark Center, который служит глобальной штаб-квартирой Papa Johns и североамериканской штаб-квартирой TK Elevator; Four Ballpark Center, где расположены коммерческие этажи Southwire и DCO; и будущая площадка для Truist Tower, в которой разместится Truist Securities. The Battery Atlanta 9 работает на базе оптоволоконной сети Comcast и обеспечивает многотерабитные возможности.0306 ™ имеет сеть с самой высокой пропускной способностью, обслуживающую любой многофункциональный комплекс в стране.
The Battery Atlanta 9 работает на базе оптоволоконной сети Comcast и обеспечивает многотерабитные возможности.0306 ™ имеет сеть с самой высокой пропускной способностью, обслуживающую любой многофункциональный комплекс в стране.
Скачать PDF
Щелкните правой кнопкой мыши изображение, чтобы изменить масштаб, щелкните правой кнопкой мыши и удерживайте для перемещения.
Ваш браузер не поддерживает видео тег.
Для этого события действуют тарифы на парковку в день мероприятия.
Направления Парковка — BatteryATL
- Instgram
- Контакт
- Парковка
- Парковка
- Транспорт
- FAQS
Неэвент Паркинг
Selfking
в неэффективных днях. бесплатно первые 3 часа ! По истечении этого времени действуют следующие тарифы:
- 3–4 часа: 10 долларов США
- 4–5 часов: 15 долларов США
- 5–6 часов: 25 долларов США
- 6–24 часа: 30 долларов США
- Максимум 30 долларов США в день30047
Orange Parking Deck – 7 долларов в час, макс.
 в день: 35 долларов
в день: 35 долларовОграниченная уличная парковка по счетчику за 7 долларов в час.
Hyundai Valet
**ВНИМАНИЕ: Hyundai Valet временно закрыт, приносим извинения за возможные неудобства.**
Hyundai Valet на Красной парковочной площадке открыт 7 дней в неделю с 11:00 до 22:00. Находится на 3-м уровне Красной колоды.
- 0–1 час $7,00
- 1–2 часа $8,00
- 2–6 часов $10,00
- 6-12 часов $20,00
- 12-24 часа $35,00
Парковка в день мероприятия
Парковка в день мероприятия Тарифы вступают в силу за 4 часа до начала каждого мероприятия и заканчиваются через 2,5 часа после начала мероприятия.
Тарифы событий включают первые 2 часа бесплатно для всех транспортных средств.
Truist Park Gameday & Event Rates
Парковка на Красной, Зеленой, Желтой и Фиолетовой палубах бесплатная в течение первых 2 часов! После этого действуют следующие тарифы:
2 – 3 часа $20.00
3–4 часа: 30 долларов США
4–24 часа: 50 долларов СШАУличная парковка с ограниченным количеством счетчиков доступна за 7 долларов США в час.

Оранжевая парковка доступна только для парковщиков Truist Club.
Услуги парковщика Hyundai Цена для всех игр Truist Park Gameday + Events: 50 долларов США
Специальные цены для событий
Парковка на красной, зеленой, желтой и фиолетовой палубах бесплатна в течение первых 2 часов, затем 20 долларов США до завершения мероприятия.
Orange Parking Deck — парковка только для Coca-Cola Roxy Event
Ограниченная уличная парковка со счетчиком доступна за 7 долларов США в час.
Стоимость услуги парковщика Hyundai для всех специальных мероприятий: 30,00 долларов США
*Обратите внимание, что если концерт в Coca-Cola Roxy приходится на один день с мероприятием Truist Park, применяются тарифы Truist Park Gameday & Event Rates .
Руководство по подтверждению парковки
В дни проведения мероприятий клиентам, парковавшимся на красной, зеленой, желтой и фиолетовой палубах в The Battery Atlanta, которые тратят 50 долларов США или более у продавцов в The Battery Atlanta, будет предоставлено подтверждение парковки непосредственно у продавца или ресторана по запросу .
 Вы можете суммировать квитанции в тот же день от продавцов The Battery Atlanta, чтобы получить 50 долларов, и можете посетить любого продавца, чтобы получить подтверждение парковки. Чеки разделения групп будут получать одну проверку за каждые потраченные 50 долларов. Покупка билетов и квитанции Hyundai Valet не учитываются при проверке билетов в день мероприятия.
Вы можете суммировать квитанции в тот же день от продавцов The Battery Atlanta, чтобы получить 50 долларов, и можете посетить любого продавца, чтобы получить подтверждение парковки. Чеки разделения групп будут получать одну проверку за каждые потраченные 50 долларов. Покупка билетов и квитанции Hyundai Valet не учитываются при проверке билетов в день мероприятия.Обратите внимание, что оранжевая колода, серебряная колода и дельта-колода исключены из проверки.
* Дни мероприятий действительны для концертов и мероприятий Coca-Cola Roxy в Truist Park. Проверки доступны только в том случае, если запись сделана в пределах временных рамок частоты событий.
Как добраться
Схема проезда
При посещении The Battery Atlanta™ парковка доступна на Красной, Зеленой, Серебряной, Желтой и Фиолетовой палубах.
Используйте Waze™, чтобы перейти прямо к парковке и получать обновления в режиме реального времени.
СКАЧАТЬ КАРТУ PDF
Общественный транспорт
Truist Park и The Battery Atlanta™ обслуживаются компаниями CobbLinc, Marta и новым Cumberland Circulator.
 Четыре маршрута от CobbLinc обслуживают The Battery Atlanta™, а MARTA 12 соединяется с Cumberland Transfer Center. Циркулятор будет обеспечивать стабильное обслуживание региона, полагаясь на частые поездки по выделенному маршруту.
Четыре маршрута от CobbLinc обслуживают The Battery Atlanta™, а MARTA 12 соединяется с Cumberland Transfer Center. Циркулятор будет обеспечивать стабильное обслуживание региона, полагаясь на частые поездки по выделенному маршруту.ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Совместные поездки
На Уинди-Ридж-Паркуэй к западу от бейсбольного стадиона есть специально отведенное место для посадки, где водители райдшеринга могут ждать пассажиров. Такой подход позволит вам выбрать следующий автомобиль в очереди, обеспечив непрерывный доступ к транспортным средствам.
- Банкомат
Для вашего удобства банкоматы расположены рядом с Coca-Cola Roxy на Бэттери-авеню и рядом с ресторанным и винным баром Cru на Бэттери-Уок.
- Парковка для велосипедов
На территории отеля Battery Atlanta имеется множество мест для парковки велосипедов. Основное укрытие для велосипедов расположено в верхней части улиц Хэнка Аарона и Бэттери-авеню (рядом с парковочной площадкой Orange).
 Дополнительные стойки для велосипедов расположены рядом с Coca-Cola Roxy на Бэттери-авеню. Во время игровых дней и специальных мероприятий, когда наши улицы закрыты для движения транспортных средств, байкеры должны подводить велосипеды к стойкам для обеспечения безопасности пешеходов и велосипедистов.
Дополнительные стойки для велосипедов расположены рядом с Coca-Cola Roxy на Бэттери-авеню. Во время игровых дней и специальных мероприятий, когда наши улицы закрыты для движения транспортных средств, байкеры должны подводить велосипеды к стойкам для обеспечения безопасности пешеходов и велосипедистов. - Киносъемка / Фотосъемка
Гости могут делать фотографии для личного использования и развлечения. Фотосъемка для коммерческого использования, организованные фотосессии для личного или коммерческого использования, видео- и аудиозапись, а также съемка с дрона требуют лицензионного соглашения и платы за бронирование. Разрешения в тот же день не предоставляются, пожалуйста, дайте по крайней мере одну полную неделю для заполнения необходимых документов при запросе вашей фотосессии. Свяжитесь с нашим отделом маркетинга по адресу [email protected], чтобы проверить наличие.
- Подарочные карты
Хотя в настоящее время мы не предлагаем эту услугу, многие из наших магазинов и ресторанов имеют подарочные карты и будут рады вам помочь.

- Домашние животные
Разрешены хорошо воспитанные четвероногие друзья, пожалуйста, всегда держите своих четвероногих друзей на поводке. Несколько ресторанов и розничных продавцов разрешают размещение с домашними животными. Пожалуйста, уточните в каждом магазине или ресторане, который вы посещаете, чтобы убедиться, что вы понимаете их индивидуальные правила. Домашние животные должны пользоваться специально отведенными местами для уборки, а владельцы несут ответственность за уборку за своими четвероногими друзьями.
- Скейтборды, самокаты (ручные и электрические) и моторизованные личные транспортные средства (сегвеи, ховерборды)
Battery Atlanta не разрешает катание на коньках, доске, велосипеде и моторизованных личных транспортных средствах на тротуарах и в зонах ограниченного доступа (таких как пешеходные зоны). включая Battery Walk и The Plaza).
- Курение/Вейпинг
В The Battery Atlanta запрещено употребление табака.
 На 3-м уровне Red Parking Deck есть одна центральная зона, где разрешено курение. Курение/Вейпинг запрещено где-либо еще в общественных местах.
На 3-м уровне Red Parking Deck есть одна центральная зона, где разрешено курение. Курение/Вейпинг запрещено где-либо еще в общественных местах. - Ходатайство
The Battery Atlanta является частной собственностью и не допускает несанкционированного распространения материалов, демонстраций, интервью, профессиональных фото-, видео- или аудиозаписей на территории.
- Splash Pad
Splash Pad работает ежедневно с 9:00 до закрытия. Бывают случаи, когда Splash Pad отключается из-за запланированных мероприятий в общей зоне (игровые дни, крупномасштабные мероприятия) или периодического обслуживания. Пожалуйста, соблюдайте правила пользования, размещенные возле фонтанов.
Мы призываем посетителей продолжать следовать рекомендациям CDC и Департамента общественного здравоохранения, укрываясь на месте как можно чаще. Если вы больны, контактировали с заболевшим или относитесь к уязвимому населению, мы просим вас оставаться дома.

В целях сохранения вашего здоровья и безопасности используйте эти места для туалетов, мест для мытья и дезинфекции рук, чтобы предотвратить распространение микробов и бактерий.
СКАЧАТЬ PDF
Щелкните правой кнопкой мыши изображение, чтобы изменить масштаб, щелкните правой кнопкой мыши и удерживайте, чтобы переместиться.
Ваш браузер не поддерживает видео тег.
Для этого события действуют тарифы на парковку в день мероприятия.
Как работает батарея — Любопытно
Представьте себе мир без батареек. Все те портативные устройства, от которых мы так зависим, были бы такими ограниченными! Мы смогли бы донести наши ноутбуки и телефоны только до предела досягаемости их кабелей, что сделало бы это новое работающее приложение, которое вы только что загрузили на свой телефон, довольно бесполезным.
К счастью, у нас есть батарейки. Еще в 150 г.
 до н.э. в Месопотамии парфянская культура использовала устройство, известное как багдадская батарея, сделанное из медных и железных электродов с уксусом или лимонной кислотой. Археологи считают, что на самом деле это не были батареи, а использовались в основном для религиозных церемоний.
до н.э. в Месопотамии парфянская культура использовала устройство, известное как багдадская батарея, сделанное из медных и железных электродов с уксусом или лимонной кислотой. Археологи считают, что на самом деле это не были батареи, а использовались в основном для религиозных церемоний.Изобретение батареи в том виде, в каком мы ее знаем, приписывают итальянскому ученому Алессандро Вольта, который собрал первую батарею, чтобы доказать точку зрения другого итальянского ученого, Луиджи Гальвани. В 1780 году Гальвани показал, что лапки лягушек, подвешенных на железных или латунных крючках, будут дергаться при прикосновении к ним зондом из какого-либо другого металла. Он считал, что это было вызвано электричеством из тканей лягушек, и называл это «животным электричеством».
Луиджи Гальвани обнаружил, что лапки лягушек, подвешенных на латунных крючках, дергались, когда их нажимали зондом из другого типа металла. Он думал, что эта реакция была вызвана «животным электричеством» внутри лягушки. Источник изображения: Луиджи Гальвани / Wikimedia Commons.
Источник изображения: Луиджи Гальвани / Wikimedia Commons.Вольта, первоначально впечатленный открытиями Гальвани, пришел к выводу, что электрический ток исходит из двух разных типов металла (крючки, на которых висят лягушки, и из другого металла зонда) и просто передается через них, а не через них. из тканей лягушек. Он экспериментировал со стопками слоев серебра и цинка, перемежаемых слоями ткани или бумаги, пропитанными соленой водой, и обнаружил, что электрический ток действительно протекал по проводу, прикрепленному к обоим концам стопки.
Батарея Алессандро Вольта: груда цинковых и серебряных листов с вкраплениями ткани или бумаги, пропитанной соленой водой. Представьте, что вы используете это для питания вашего телефона. Источник изображения: Луиджи Кьеза / Wikimedia Commons.Вольта также обнаружил, что, используя различные металлы в куче, можно увеличить величину напряжения. Он описал свои открытия в письме Джозефу Бэнксу, тогдашнему президенту Лондонского королевского общества, в 1800 году.
 ‘ (мера электрического потенциала) названа в его честь.
‘ (мера электрического потенциала) названа в его честь.Я сам, если не считать шуток, поражаюсь тому, как мои старые и новые открытия… чистого и простого электричества, вызываемого контактом металлов, могли вызвать такой ажиотаж.
Алессандро ВольтаТак что же именно происходило с этими слоями цинка и серебра, да и с дергающимися лягушачьими лапками?
Химия батареи
Батарея представляет собой устройство, которое накапливает химическую энергию и преобразует ее в электричество. Это известно как электрохимия, а система, которая лежит в основе батареи, называется электрохимической ячейкой. Батарея может состоять из одного или нескольких (как в исходной куче Вольты) электрохимических элементов. Каждая электрохимическая ячейка состоит из двух электродов, разделенных электролитом.
Так откуда электрохимический элемент получает электричество? Чтобы ответить на этот вопрос, нам нужно знать, что такое электричество.
 Проще говоря, электричество — это тип энергии, производимый потоком электронов. В электрохимической ячейке электроны образуются в результате химической реакции, которая происходит на одном электроде (подробнее об электродах ниже!), а затем перетекают на другой электрод, где они расходуются. Чтобы понять это правильно, нам нужно поближе взглянуть на компоненты клетки и на то, как они собираются вместе.
Проще говоря, электричество — это тип энергии, производимый потоком электронов. В электрохимической ячейке электроны образуются в результате химической реакции, которая происходит на одном электроде (подробнее об электродах ниже!), а затем перетекают на другой электрод, где они расходуются. Чтобы понять это правильно, нам нужно поближе взглянуть на компоненты клетки и на то, как они собираются вместе.Электроды
Чтобы создать поток электронов, вам нужно куда-то, чтобы электроны текли из и куда-то, чтобы электроны текли в . Это электроды клетки. Электроны текут от одного электрода, называемого анодом (или отрицательным электродом), к другому электроду, называемому катодом (положительный электрод). Как правило, это различные типы металлов или других химических соединений.
В батарее Вольта анодом был цинк, от которого электроны текли по проводу (при подключении) к серебру, которое было катодом батареи. Он сложил множество этих элементов вместе, чтобы сделать общую кучу и поднять напряжение.

Но откуда анод получает все эти электроны? И почему они так счастливы, что их весело отправляют на катод? Все сводится к химии, которая происходит внутри клетки.
Происходит несколько химических реакций, которые нам нужно понять. На аноде электрод вступает в реакцию с электролитом, в результате которой образуются электроны. Эти электроны накапливаются на аноде. Тем временем на катоде одновременно происходит другая химическая реакция, которая позволяет этому электроду принимать электроны.
Технический химический термин для обозначения реакции, включающей обмен электронами, представляет собой реакцию восстановления-окисления, чаще называемую окислительно-восстановительной реакцией. Всю реакцию можно разделить на две полуреакции, а в случае электрохимической ячейки одна полуреакция происходит на аноде, другая на катоде. Восстановление — это присоединение электронов, и это то, что происходит на катоде; мы говорим, что катод восстанавливается в ходе реакции. Окисление — это потеря электронов, поэтому мы говорим, что анод окисляется.

Каждая из этих реакций имеет определенный стандартный потенциал. Думайте об этой характеристике как о способности/эффективности реакции либо производить, либо поглощать электроны — ее сила в перетягивании каната электронами.
- Стандартные потенциалы для полуреакций
Ниже приведен список полуреакций, которые включают высвобождение электронов из чистого элемента или химического соединения. Рядом с реакцией указано число (E 0 ), которое сравнивает силу электрохимического потенциала реакции с силой готовности водорода расстаться со своим электроном (если вы посмотрите вниз по списку, вы увидите, что водородная полуреакция имеет Е 0 нуля). E 0 измеряется в вольтах.
Причина, по которой этот список настолько интересен, заключается в том, что если вы выберете две реакции из списка и объедините их для создания электрохимической ячейки, значения E 0 скажут вам, каким образом будет протекать общая реакция: реакция с более отрицательное значение E 0 отдаст свои электроны другой реакции, и это определяет анод и катод вашей ячейки.
 Разница между двумя значениями E 0 говорит вам об электрохимическом потенциале вашей клетки, который в основном представляет собой напряжение ячейки.
Разница между двумя значениями E 0 говорит вам об электрохимическом потенциале вашей клетки, который в основном представляет собой напряжение ячейки.Итак, если вы возьмете литий и фтор и сумеете соединить их для создания элемента батареи, вы получите максимальное напряжение, теоретически достижимое для гальванического элемента. Этот список также объясняет, почему в куче Вольта цинк был анодом, а серебро катодом: полуреакция цинка имеет более низкое (более отрицательное) значение E 0 (-0,7618), чем полуреакция серебра (0,7996). .
Стандартные потенциалы полуреакций восстановления
(по отношению к стандартному водородному электроду при 25°C)
В° (В) Li + (водн.) + e − Li(s) –3,040 Be 2+ (водн.) + 2e − Be(s) –1,99 Al 3+ (водн.  ) + 3e − Al(s)
) + 3e − Al(s)–1,676 Zn 2+ (водный) + 2e − Zn(s) –0,7618 Ag 2 S(s) + 2e − 2Ag(s) + S 2− (водн.) –0,71 Fe 2+ (водн.) + 2e − Fe(тв) –0,44 Cr 3+ (водн.) + e − Cr 2+ (водн.) –0,424 Cd 2+ (водн.) + 2e − Cd(s) –0,4030 PbSO 4 (т) + 2e − Pb(т) + SO 4 2− (водн.) –0,356 Ni 2+ (водн.) + 2e − Ni(т) –0,257 2SO 4 2− (водн.) + 4H + (водн.) + 2e − S 2 O 6 − 2307 (водн.) + 2H 2 O(л) –0,25 Sn 2+ (водн.  ) + 2e − Sn(s)
) + 2e − Sn(s)−0,14 2H + (водн.) + 2e − H 2 (г) 0 Sn 4+ (водн.) + 2e − Sn 2+ (водн.) 0,154 Cu 2+ (водн.) + e − Cu + (водн.) 0,159 AgCl(тв) + e − Ag(тв) + Cl − (водн.) 0,2223 Cu 2+ (водн.) + 2e − Cu(s) 0,3419 O 2 (г) + 2H 2 O(ж) + 4e − 4OH − (водн.) 0,401 H 2 SO 3 (водн.) + 4H + (водн.) + 4e − S(т) + 3H 2 O(л) 0,45 I 2 (s) + 2e − 2I − (aq) 0,5355 MnO 4 2− (водн.  ) + 2H 2 O(ж) + 2e − MnO 2 (тв) + 4OH ( − − )
) + 2H 2 O(ж) + 2e − MnO 2 (тв) + 4OH ( − − )0,6 O 2 (г) + 2H + (водн.) + 2e − H 2 O 2 (водный) 0,695 H 2 SeO 3 (водн.) + 4H + + 4e − Se(s) + 3H 2 O(l) 0,74 Fe 3+ (водн.) + e − Fe 2+ (водн.) 0,771 Ag + (водный) + e − Ag(s) 0,7996 NO 3 − (водн.) + 3H + (водн.) + 2e − HNO 2 (водн.) + H 2 O(l) 0,94 Br 2 (водн.) + 2e − 2Br − (водн.) 1.087 MnO 2 (т) + 4H + (водн.) + 2e − Mn 2+ (водн.  ) + 2H 2 O(л)
) + 2H 2 O(л)1,23 О 2 (г) + 4H + (водн.) + 4e − 2H 2 O(л) 1,229 CR 2 O 7 2- (AQ) + 14H + (AQ) + 6E — 2CR 3+ (AQ) + 7H 2 сь. 1,36 Cl 2 (г) + 2e − 2Cl − (водн.) 1,396 Ce 4+ (водн.)+e − Се 3+ (водный) 1,44 PBO 2 (S) + HSO 4 — (AQ) + 3H + (AQ) + 2E — PBSO 4 (S) + 2H 2 903 1,69 H 2 O 2 (водн.) + 2H + (водн.) + 2e − 2H 2 O(л) 1,763 F 2 (г) + 2е − 2F − (водный) 2,87 Источник: UC Davis ChemWiki
Любые два проводящих материала, вступающих в реакцию с разными стандартными потенциалами, могут образовать электрохимическую ячейку, потому что более сильный сможет отбирать электроны у более слабого.
 Но идеальным выбором для анода был бы материал, который вызывает реакцию со значительно более низким (более отрицательным) стандартным потенциалом, чем материал, который вы выбрали для своего катода. В итоге мы получаем, что электроны притягиваются к катоду от анода (и анод не пытается сильно сопротивляться), и когда у нас есть легкий путь туда — проводящий провод — мы можем использовать их энергию для обеспечения электрического тока. питание на фонарик, телефон или что-то еще.
Но идеальным выбором для анода был бы материал, который вызывает реакцию со значительно более низким (более отрицательным) стандартным потенциалом, чем материал, который вы выбрали для своего катода. В итоге мы получаем, что электроны притягиваются к катоду от анода (и анод не пытается сильно сопротивляться), и когда у нас есть легкий путь туда — проводящий провод — мы можем использовать их энергию для обеспечения электрического тока. питание на фонарик, телефон или что-то еще.Разница в стандартном потенциале между электродами примерно равна силе, с которой электроны перемещаются между двумя электродами. Это известно как общий электрохимический потенциал ячейки, и он определяет напряжение ячейки. Чем больше разница, тем больше электрохимический потенциал и выше напряжение.
Чтобы увеличить напряжение батареи, у нас есть два варианта. Мы могли бы выбрать разные материалы для наших электродов, которые придадут клетке больший электрохимический потенциал. Или мы можем сложить несколько ячеек вместе.
 Когда элементы объединены определенным образом (последовательно), это оказывает аддитивное влияние на напряжение батареи. По сути, силу, с которой электроны движутся через батарею, можно рассматривать как общую силу, когда они движутся от анода первой ячейки через все ячейки, содержащиеся в батарее, к катоду последней ячейки.
Когда элементы объединены определенным образом (последовательно), это оказывает аддитивное влияние на напряжение батареи. По сути, силу, с которой электроны движутся через батарею, можно рассматривать как общую силу, когда они движутся от анода первой ячейки через все ячейки, содержащиеся в батарее, к катоду последней ячейки.Когда ячейки объединены другим способом (параллельно), это увеличивает возможный ток батареи, который можно рассматривать как общее количество электронов, протекающих через ячейки, но не как их напряжение.
Электролит
Но электроды — это только часть батареи. Помните бумажки Вольта, смоченные в соленой воде? Соленая вода была электролитом, еще одной важной частью картины. Электролит может быть жидкостью, гелем или твердым веществом, но он должен обеспечивать движение заряженных ионов.
Электроны имеют отрицательный заряд, и, поскольку мы посылаем поток отрицательных электронов по нашей цепи, нам нужен способ сбалансировать движение этого заряда.
 Электролит обеспечивает среду, через которую могут протекать положительные ионы, уравновешивающие заряд.
Электролит обеспечивает среду, через которую могут протекать положительные ионы, уравновешивающие заряд.Поскольку химическая реакция на аноде приводит к образованию электронов, для поддержания баланса нейтрального заряда на электроде также производится соответствующее количество положительно заряженных ионов. Они не идут по внешнему проводу (это только для электронов!), а выбрасываются в электролит.
В то же время катод также должен уравновешивать отрицательный заряд электронов, которые он получает, поэтому происходящая здесь реакция должна втягивать положительно заряженные ионы из электролита (в качестве альтернативы она может также высвобождать отрицательно заряженные ионы из электрода в электролит).
Таким образом, в то время как внешний провод обеспечивает путь для потока отрицательно заряженных электронов, электролит обеспечивает путь для передачи положительно заряженных ионов, чтобы сбалансировать отрицательный поток. Этот поток положительно заряженных ионов столь же важен, как и электроны, обеспечивающие электрический ток во внешней цепи, которую мы используем для питания наших устройств.
 Роль балансировки заряда, которую они выполняют, необходима для поддержания всей реакции.
Роль балансировки заряда, которую они выполняют, необходима для поддержания всей реакции.Теперь, если позволить всем ионам, выпущенным в электролит, полностью свободно перемещаться через электролит, они закончат тем, что покроют поверхности электродов и засорят всю систему. Таким образом, у клетки обычно есть какой-то барьер, чтобы предотвратить это.
Показывать метки во время анимации Начать анимацию
При использовании батареи имеет место непрерывный поток электронов (через внешнюю цепь) и положительно заряженных ионов (через электролит). Если этот непрерывный поток остановлен — если цепь разомкнута, например, когда ваш фонарик выключен — поток электронов остановится. Заряды будут накапливаться, и химические реакции, управляющие батареей, прекратятся.
По мере использования батареи и протекания реакций на обоих электродах производятся новые химические продукты. Эти продукты реакции могут создать своего рода сопротивление, которое может помешать протеканию реакции с той же эффективностью.
 Когда это сопротивление становится слишком большим, реакция замедляется. Электронное перетягивание каната между катодом и анодом также теряет свою силу, и поток электронов прекращается. Аккумулятор медленно садится.
Когда это сопротивление становится слишком большим, реакция замедляется. Электронное перетягивание каната между катодом и анодом также теряет свою силу, и поток электронов прекращается. Аккумулятор медленно садится.Зарядка аккумулятора
Некоторые распространенные батареи предназначены только для одноразового использования (известные как первичные или одноразовые батареи). Путешествие электронов от анода к катоду является односторонним. Либо их электроды истощаются, когда они выделяют свои положительные или отрицательные ионы в электролит, либо накопление продуктов реакции на электродах препятствует продолжению реакции, и дело сделано и запылено. Аккумулятор попадает в мусорное ведро (или, надеюсь, на переработку, но это совсем другая тема Nova).
Но. Преимущество этого потока ионов и электронов в том, что он имеет место в некоторых типах батарей с соответствующими материалами электродов, заключается в том, что он также может двигаться в обратном направлении, возвращая нашу батарею в исходную точку и давая ей совершенно новую жизнь.
 . Точно так же, как батареи изменили то, как мы можем использовать различные электрические устройства, перезаряжаемые батареи еще больше изменили полезность и срок службы этих устройств.
. Точно так же, как батареи изменили то, как мы можем использовать различные электрические устройства, перезаряжаемые батареи еще больше изменили полезность и срок службы этих устройств.Когда мы подключаем почти разряженную батарею к внешнему источнику электроэнергии и отправляем энергию обратно в батарею, она обращает вспять химическую реакцию, которая произошла во время разряда. Это отправляет положительные ионы, выпущенные из анода в электролит, обратно к аноду, а электроны, которые принял катод, также возвращаются к аноду. Возвращение как положительных ионов, так и электронов обратно в анод запускает систему, поэтому она снова готова к работе: ваша батарея перезаряжена.
Показывать метки во время анимации Начать анимацию
Однако процесс не идеален. Замена отрицательных и положительных ионов из электролита обратно на соответствующий электрод по мере перезарядки батареи происходит не так аккуратно и красиво, как электрод изначально.
 Каждый цикл зарядки ухудшает состояние электродов еще немного, а это означает, что батарея со временем теряет производительность, поэтому даже перезаряжаемые батареи не могут работать вечно.
Каждый цикл зарядки ухудшает состояние электродов еще немного, а это означает, что батарея со временем теряет производительность, поэтому даже перезаряжаемые батареи не могут работать вечно.В течение нескольких циклов зарядки и разрядки форма кристаллов батареи становится менее упорядоченной. Это усугубляется, когда батарея разряжается/перезаряжается с высокой скоростью, например, если вы едете на своем электромобиле большими рывками, а не постоянно. Циклирование с высокой скоростью приводит к тому, что кристаллическая структура становится более неупорядоченной, в результате чего батарея становится менее эффективной.
Эффект памяти и саморазряд
Почти полностью обратимые реакции разрядки и перезарядки также способствуют так называемому «эффекту памяти». Когда вы перезаряжаете некоторые типы перезаряжаемых батарей, предварительно не разрядив их в достаточной степени, они «вспоминают», на каком уровне они были в предыдущих циклах разрядки, и не заряжаются должным образом.

В некоторых элементах это вызвано тем, как металл и электролит реагируют с образованием соли (и тем, как соль затем снова растворяется, а металл заменяется на электродах при перезарядке). Мы хотим, чтобы наши клетки имели красивые, однородные маленькие кристаллы соли, покрывающие идеальную металлическую поверхность, но это не то, что мы получаем в реальном мире! Способ формирования некоторых кристаллов очень сложен, и способ осаждения некоторых металлов во время перезарядки также удивительно сложен, поэтому некоторые типы батарей имеют больший эффект памяти, чем другие. Несовершенства в основном зависят от состояния заряда батареи, температуры, зарядного напряжения и зарядного тока. Со временем недостатки в одном цикле зарядки могут вызвать то же самое в следующем цикле зарядки и т. д., и наша батарея накапливает некоторые плохие воспоминания. Эффект памяти силен для некоторых типов элементов, таких как батареи на основе никеля. Другие типы, такие как литий-ионные, не страдают от этой проблемы.

Еще один аспект аккумуляторных батарей заключается в том, что химический состав, благодаря которому их можно перезаряжать, также означает, что они имеют более высокую склонность к саморазряду. Это когда внутри элемента батареи происходят внутренние реакции, даже когда электроды не подключены через внешнюю цепь. Это приводит к тому, что клетка со временем теряет часть своей химической энергии. Высокая скорость саморазряда серьезно ограничивает срок службы батареи и заставляет ее умирать при хранении.
Литий-ионные аккумуляторы в наших мобильных телефонах имеют довольно хорошую скорость саморазряда, около 2–3 % в месяц, и наши свинцово-кислотные автомобильные аккумуляторы также довольно разумны — они имеют тенденцию терять 4–6 %. в месяц. Аккумуляторы на основе никеля теряют около 10–15 процентов своего заряда в месяц, что не очень хорошо, если вы планируете хранить фонарь целый сезон, когда он вам не нужен! Неперезаряжаемая щелочная батарея теряет всего около 2–3 процентов своего заряда в год.

Напряжение, ток, мощность, мощность… в чем разница?
Все эти слова в основном описывают мощность батареи, верно? Ну вроде. Но все они немного разные.
Напряжение = сила, при которой реакция, приводящая в движение батарею, проталкивает электроны через ячейку. Это также известно как электрический потенциал и зависит от разности потенциалов между реакциями, происходящими на каждом из электродов, то есть от того, насколько сильно катод будет тянуть электроны (через цепь) от анода. Чем выше напряжение, тем большую работу может совершить одно и то же число электронов.
Ток = количество электронов, проходящих через любую точку цепи в данный момент времени. Чем больше сила тока, тем больше работы он может совершить при том же напряжении. Внутри ячейки вы также можете думать о токе как о количестве ионов, движущихся через электролит, умноженном на заряд этих ионов.
Мощность = напряжение x ток. Чем выше мощность, тем выше скорость, с которой батарея может работать — это соотношение показывает, насколько важны напряжение и ток для определения того, для чего подходит батарея.

Емкость = мощность батареи как функция времени, которая используется для описания периода времени, в течение которого батарея сможет питать устройство. Аккумулятор большой емкости сможет работать в течение более длительного периода, прежде чем разрядится или разрядится. У некоторых аккумуляторов есть небольшая грустная особенность: если вы попытаетесь извлечь из них слишком много слишком быстро, вовлеченные химические реакции не смогут продолжаться, и емкость уменьшится! Таким образом, мы всегда должны быть осторожны, когда говорим о емкости батареи и помнить, для чего она будет использоваться.
Другой популярный термин — «плотность энергии». Это количество энергии, которое устройство может удерживать на единицу объема, другими словами, какую отдачу вы получаете за свои деньги с точки зрения мощности и размера. С аккумулятором, как правило, чем выше плотность энергии, тем лучше, так как это означает, что аккумулятор может быть меньше и компактнее, что всегда является плюсом, когда он нужен для питания чего-то, что вы хотите держать в кармане.
 Для электромобилей это даже плюс — аккумулятор должен как-то влезать в машину!
Для электромобилей это даже плюс — аккумулятор должен как-то влезать в машину!Для некоторых приложений, таких как хранение электроэнергии на возобновляемой электростанции, такой как ветряная или солнечная электростанция, высокая плотность энергии не является большой проблемой, так как у них, скорее всего, будет достаточно места для хранения батарей. Основной целью такого использования было бы просто хранить как можно больше электроэнергии, как можно безопаснее и дешевле.
Видео: Как работают аккумуляторы? (TED-Ed/YouTube). Посмотреть подробности и расшифровку.
Почему так много типов?
Ряд материалов (раньше это были просто металлы) можно использовать в качестве электродов в батарее. За прошедшие годы было опробовано много-много различных комбинаций, но лишь немногие из них действительно прошли дистанцию. Но зачем вообще использовать разные комбинации металлов? Если у вас есть пара металлов, которые хорошо работают вместе в качестве электродов, зачем возиться с другими?
Различные материалы имеют разные электрохимические свойства, поэтому они дают разные результаты, когда вы кладете их вместе в аккумуляторную ячейку.
 Например, некоторые комбинации будут создавать высокое напряжение очень быстро, но затем быстро падать, не в состоянии поддерживать это напряжение в течение длительного времени. Это хорошо, если вам нужно произвести, скажем, внезапную вспышку света, как вспышка фотокамеры.
Например, некоторые комбинации будут создавать высокое напряжение очень быстро, но затем быстро падать, не в состоянии поддерживать это напряжение в течение длительного времени. Это хорошо, если вам нужно произвести, скажем, внезапную вспышку света, как вспышка фотокамеры.Другие комбинации дадут лишь струйку тока, но они будут поддерживать эту струйку на века. Например, нам не нужно большое количество тока для питания детектора дыма, но мы хотим, чтобы наши детекторы дыма работали долгое время.
Еще одна причина для использования различных комбинаций металлов заключается в том, что часто для получения требуемого напряжения необходимо сложить два или более элемента батареи, и оказывается, что некоторые комбинации электродов складываются вместе гораздо лучше, чем другие комбинации. Например, литий-железо-фосфатные батареи (разновидность литий-ионных батарей), используемые в электромобилях, объединяются вместе для создания систем высокого напряжения (100 и даже более вольт), но вы никогда не сделаете этого с теми никель-кадмиевыми батареями Walkman, которые получают горячий!
Наши различные потребности со временем привели к разработке огромного количества типов батарей.
Эта тема является частью нашей серии статей о батареях, состоящей из четырех частей. Для дальнейшего чтения см. Типы аккумуляторов, литий-ионные аккумуляторы и аккумуляторы будущего. Чтобы узнать больше о них и о том, что ждет аккумулятор в будущем, ознакомьтесь с другими нашими темами Nova.
Чтобы узнать больше о них и о том, что ждет аккумулятор в будущем, ознакомьтесь с другими нашими темами Nova.Литий-ионный аккумулятор — Институт чистой энергии
Что такое литий-ионный аккумулятор и как он работает?Литий-ионный (Li-ion) аккумулятор представляет собой передовую технологию аккумуляторов, в которой ионы лития используются в качестве ключевого компонента его электрохимии. Во время цикла разряда атомы лития в аноде ионизируются и отделяются от своих электронов. Ионы лития движутся от анода и проходят через электролит, пока не достигнут катода, где они рекомбинируют со своими электронами и электрически нейтрализуются. Ионы лития достаточно малы, чтобы проходить через микропроницаемый разделитель между анодом и катодом. Отчасти из-за небольшого размера лития (уступая только водороду и гелию) литий-ионные батареи способны иметь очень высокое напряжение и запас заряда на единицу массы и единицы объема.

В литий-ионных батареях в качестве электродов могут использоваться различные материалы. Наиболее распространенной комбинацией является комбинация оксида лития-кобальта (катод) и графита (анод), которая чаще всего встречается в портативных электронных устройствах, таких как мобильные телефоны и ноутбуки. Другие катодные материалы включают оксид лития-марганца (используемый в гибридных электрических и электрических автомобилях) и фосфат лития-железа. В литий-ионных батареях в качестве электролита обычно используется эфир (класс органических соединений).
Применение аккумуляторов
Математические модели эффективности батарей
vimeo.com/video/221372725?dnt=1&app_id=122963″ frameborder=»0″ allow=»autoplay; fullscreen» allowfullscreen=»»> Каковы некоторые преимущества литий-ионных батарей?По сравнению с другими высококачественными аккумуляторами (никель-кадмиевые или никель-металлогидридные) литий-ионные аккумуляторы имеют ряд преимуществ. У них одна из самых высоких плотностей энергии среди аккумуляторных технологий на сегодняшний день (100-265 Втч/кг или 250-670 Втч/л). Кроме того, литий-ионные аккумуляторные элементы могут выдавать напряжение до 3,6 В, что в 3 раза выше, чем у таких технологий, как Ni-Cd или Ni-MH. Это означает, что они могут обеспечивать большое количество тока для мощных приложений, в которых литий-ионные батареи также сравнительно просты в обслуживании и не требуют плановых циклов для продления срока службы батареи. Литий-ионные аккумуляторы не имеют эффекта памяти, пагубного процесса, при котором повторяющиеся циклы частичной разрядки/зарядки могут привести к тому, что аккумулятор «запомнит» более низкую емкость.
 Это преимущество как перед Ni-Cd, так и перед Ni-MH, которые проявляют этот эффект. Литий-ионные аккумуляторы также имеют низкую скорость саморазряда, составляющую около 1,5-2% в месяц. Они не содержат токсичного кадмия, что облегчает их утилизацию по сравнению с Ni-Cd батареями.
Это преимущество как перед Ni-Cd, так и перед Ni-MH, которые проявляют этот эффект. Литий-ионные аккумуляторы также имеют низкую скорость саморазряда, составляющую около 1,5-2% в месяц. Они не содержат токсичного кадмия, что облегчает их утилизацию по сравнению с Ni-Cd батареями.Благодаря этим преимуществам литий-ионные аккумуляторы вытеснили никель-кадмиевые аккумуляторы и заняли лидирующие позиции на рынке портативных электронных устройств (таких как смартфоны и ноутбуки). Литий-ионные батареи также используются для питания электрических систем в некоторых аэрокосмических приложениях, в частности, в новом и более экологичном Боинге 787, где вес является значительным фактором стоимости. С точки зрения экологически чистой энергии большая часть перспектив литий-ионных технологий исходит из их потенциального применения в автомобилях с батарейным питанием. В настоящее время самые продаваемые электромобили Nissan Leaf и Tesla Model S используют литий-ионные аккумуляторы в качестве основного источника топлива.
Каковы недостатки литий-ионных аккумуляторов?
Несмотря на свои технологические перспективы, литий-ионные аккумуляторы по-прежнему имеют ряд недостатков, особенно в отношении безопасности. Литий-ионные аккумуляторы имеют тенденцию к перегреву и могут быть повреждены при высоких напряжениях. В некоторых случаях это может привести к тепловому разгону и возгоранию. Это вызвало серьезные проблемы, в частности, остановку парка самолетов Boeing 787 после того, как поступили сообщения о возгорании бортовых батарей. Из-за рисков, связанных с этими батареями, ряд транспортных компаний отказываются выполнять массовые перевозки батарей самолетами. Для литий-ионных аккумуляторов требуются защитные механизмы для ограничения напряжения и внутреннего давления, что в некоторых случаях может увеличить вес и ограничить производительность. Литий-ионные аккумуляторы также подвержены старению, а это означает, что они могут терять емкость и часто выходят из строя через несколько лет.
 Еще одним фактором, ограничивающим их широкое распространение, является их стоимость, которая примерно на 40% выше, чем у Ni-Cd. Решение этих проблем является ключевым компонентом текущих исследований в области технологии. Наконец, несмотря на высокую плотность энергии литий-ионных аккумуляторов по сравнению с другими типами аккумуляторов, они по-прежнему имеют примерно в сто раз меньшую плотность энергии, чем бензин (который содержит 12 700 Втч/кг по массе или 8760 Втч/л по объему).
Еще одним фактором, ограничивающим их широкое распространение, является их стоимость, которая примерно на 40% выше, чем у Ni-Cd. Решение этих проблем является ключевым компонентом текущих исследований в области технологии. Наконец, несмотря на высокую плотность энергии литий-ионных аккумуляторов по сравнению с другими типами аккумуляторов, они по-прежнему имеют примерно в сто раз меньшую плотность энергии, чем бензин (который содержит 12 700 Втч/кг по массе или 8760 Втч/л по объему).Вклады CEI
Основные результаты исследований
Одним из способов, которым CEI работала для достижения этой цели, является прямая визуализация, в частности, с использованием рентгеновской спектроскопии. Недавно в лаборатории профессора Джерри Зайдлера был разработан метод проведения рентгеновской спектроскопии ближней краевой структуры (XANES) на рабочем столе. Этот метод может позволить относительно подробные измерения определенных характеристик внутреннего состояния батареи без необходимости вскрывать ее и, таким образом, нарушать работу системы.
 Раньше XANES можно было реализовать только с чрезвычайно высоким потоком излучения от таких инструментов, как синхротрон. Это чрезвычайно большие и дорогие установки стоимостью до 1 миллиарда долларов, которые пользуются таким большим спросом среди ученых, что многомесячные списки ожидания становятся нормой. Используя преимущества новых передовых оптических технологий, лаборатория Зайдлера смогла изготовить небольшой прибор стоимостью 25 000 долларов, который может имитировать измерения, проводимые на синхротроне. С помощью этого нового инструмента ученые могут получать результаты в течение нескольких часов без значительного времени ожидания, что значительно увеличивает скорость разработки нестандартных технологий.
Раньше XANES можно было реализовать только с чрезвычайно высоким потоком излучения от таких инструментов, как синхротрон. Это чрезвычайно большие и дорогие установки стоимостью до 1 миллиарда долларов, которые пользуются таким большим спросом среди ученых, что многомесячные списки ожидания становятся нормой. Используя преимущества новых передовых оптических технологий, лаборатория Зайдлера смогла изготовить небольшой прибор стоимостью 25 000 долларов, который может имитировать измерения, проводимые на синхротроне. С помощью этого нового инструмента ученые могут получать результаты в течение нескольких часов без значительного времени ожидания, что значительно увеличивает скорость разработки нестандартных технологий.Еще один аспект исследования батарей CEI включает создание физических, математических и вычислительных моделей внутреннего состояния батареи. Это может помочь оптимизировать производительность батареи и циклы зарядки/разрядки, а также прогнозировать и предотвращать опасные отказы батареи.
Другие направления Профессор Венкат Субраманян, руководитель Лаборатории моделирования, анализа и управления технологическими процессами для электрохимических систем (MAPLE), разрабатывает и переформулирует физические модели батарей, а также работает над методами моделирования и решения этих моделей с большей эффективностью и точностью. Создав более эффективную, универсальную и точную модель технологии литий-ионных аккумуляторов, M.A.P.L.E. Исследования лаборатории могут помочь в разработке аккумуляторов более точно для более безопасной и эффективной работы.
Профессор Венкат Субраманян, руководитель Лаборатории моделирования, анализа и управления технологическими процессами для электрохимических систем (MAPLE), разрабатывает и переформулирует физические модели батарей, а также работает над методами моделирования и решения этих моделей с большей эффективностью и точностью. Создав более эффективную, универсальную и точную модель технологии литий-ионных аккумуляторов, M.A.P.L.E. Исследования лаборатории могут помочь в разработке аккумуляторов более точно для более безопасной и эффективной работы.Большая часть текущих исследований CEI направлена на разработку способов лучшего понимания и управления важными внутренними состояниями литий-ионных аккумуляторов. Понимание внутренней работы батареи имеет важное значение для улучшения конструкции и оценки режимов ее отказа.
Другим крупным направлением исследований CEI является разработка новых материалов для улучшения характеристик аккумуляторов.
 В центре внимания CEI находятся как наука о материалах высокого уровня, такая как разработка и замена альтернативных материалов в литий-ионных батареях, так и характеристика и дизайн наноструктурированных материалов или материалов, свойства которых определяются даже с точностью до нанометра. . Исследователи CEI также изучают материалы, которые могут предложить альтернативу технологиям литий-ионных аккумуляторов.
В центре внимания CEI находятся как наука о материалах высокого уровня, такая как разработка и замена альтернативных материалов в литий-ионных батареях, так и характеристика и дизайн наноструктурированных материалов или материалов, свойства которых определяются даже с точностью до нанометра. . Исследователи CEI также изучают материалы, которые могут предложить альтернативу технологиям литий-ионных аккумуляторов.Кремний исследуется в качестве анодного материала, поскольку он может образовывать трехмерную клетку с большей способностью поглощать литий.
Узнать больше
- Веб-сайт, посвященный батареям и их повторному использованию, создан студентом REU Alek Lazarski «Мост чистой энергии» На веб-странице исследовательской группы
- Subramanian есть актуальные публикации о прогнозирующем управлении нелинейными моделями для литий-ионных аккумуляторов и других электрохимических систем.
- Институт чистой энергии (UW) ускоряет масштабные исследования чистой энергии, включая солнечную энергию нового поколения, материалы для аккумуляторов, а также их интеграцию с системами и сетью.


 Алюминий
Алюминий
 Меняя параметры, меняется и порог замерзания.
Меняя параметры, меняется и порог замерзания.


 в день: 35 долларов
в день: 35 долларов
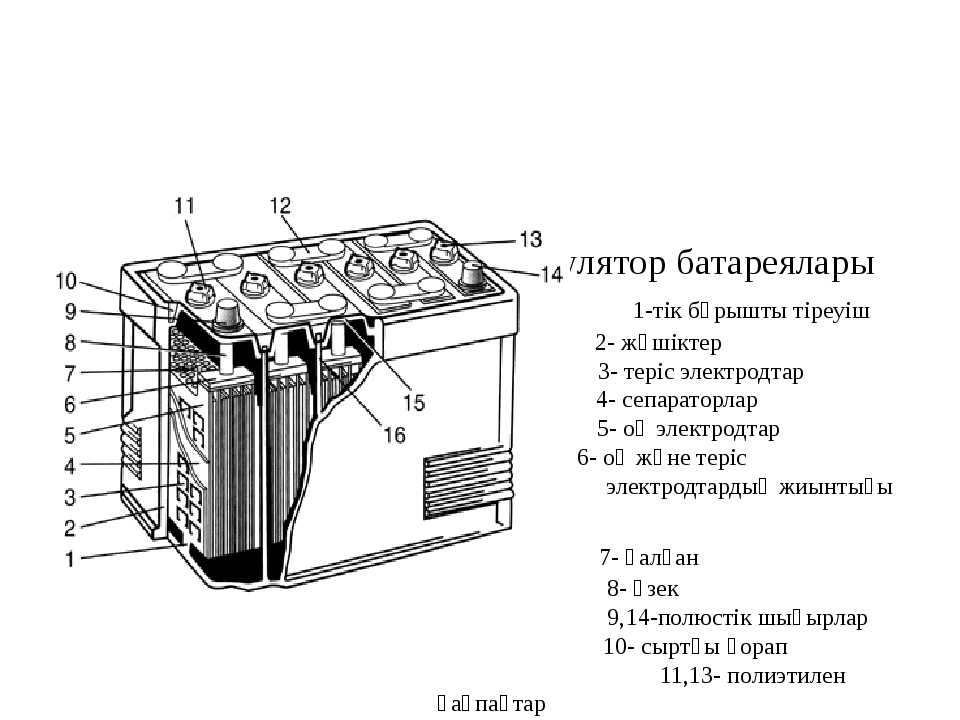 Вы можете суммировать квитанции в тот же день от продавцов The Battery Atlanta, чтобы получить 50 долларов, и можете посетить любого продавца, чтобы получить подтверждение парковки. Чеки разделения групп будут получать одну проверку за каждые потраченные 50 долларов. Покупка билетов и квитанции Hyundai Valet не учитываются при проверке билетов в день мероприятия.
Вы можете суммировать квитанции в тот же день от продавцов The Battery Atlanta, чтобы получить 50 долларов, и можете посетить любого продавца, чтобы получить подтверждение парковки. Чеки разделения групп будут получать одну проверку за каждые потраченные 50 долларов. Покупка билетов и квитанции Hyundai Valet не учитываются при проверке билетов в день мероприятия. Четыре маршрута от CobbLinc обслуживают The Battery Atlanta™, а MARTA 12 соединяется с Cumberland Transfer Center. Циркулятор будет обеспечивать стабильное обслуживание региона, полагаясь на частые поездки по выделенному маршруту.
Четыре маршрута от CobbLinc обслуживают The Battery Atlanta™, а MARTA 12 соединяется с Cumberland Transfer Center. Циркулятор будет обеспечивать стабильное обслуживание региона, полагаясь на частые поездки по выделенному маршруту.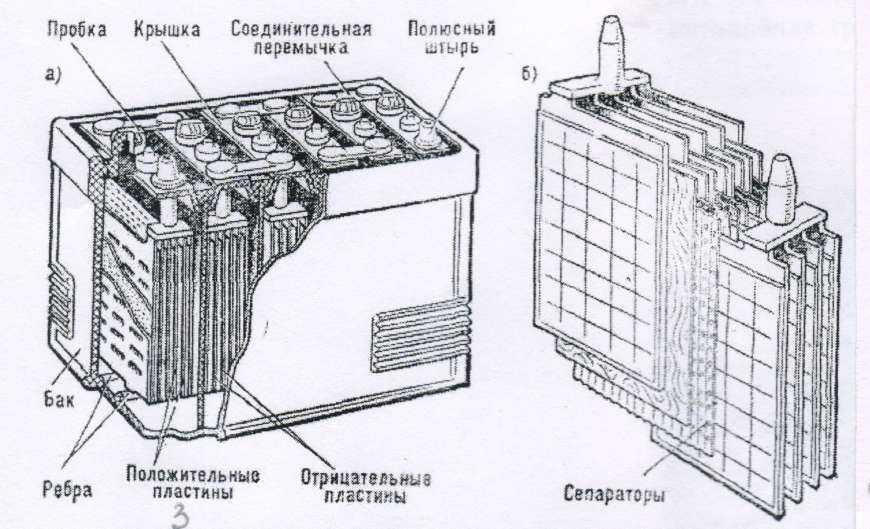 Дополнительные стойки для велосипедов расположены рядом с Coca-Cola Roxy на Бэттери-авеню. Во время игровых дней и специальных мероприятий, когда наши улицы закрыты для движения транспортных средств, байкеры должны подводить велосипеды к стойкам для обеспечения безопасности пешеходов и велосипедистов.
Дополнительные стойки для велосипедов расположены рядом с Coca-Cola Roxy на Бэттери-авеню. Во время игровых дней и специальных мероприятий, когда наши улицы закрыты для движения транспортных средств, байкеры должны подводить велосипеды к стойкам для обеспечения безопасности пешеходов и велосипедистов.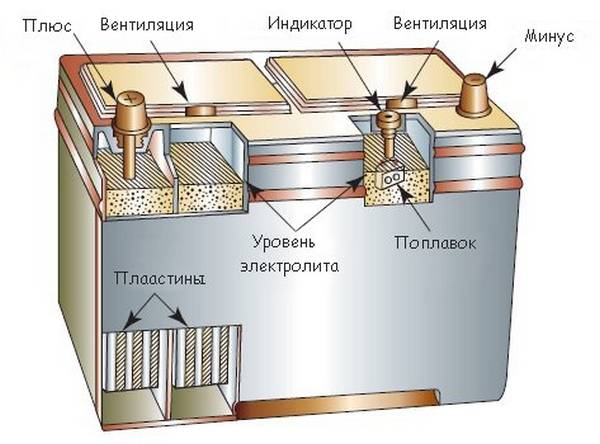
 На 3-м уровне Red Parking Deck есть одна центральная зона, где разрешено курение. Курение/Вейпинг запрещено где-либо еще в общественных местах.
На 3-м уровне Red Parking Deck есть одна центральная зона, где разрешено курение. Курение/Вейпинг запрещено где-либо еще в общественных местах.
 до н.э. в Месопотамии парфянская культура использовала устройство, известное как багдадская батарея, сделанное из медных и железных электродов с уксусом или лимонной кислотой. Археологи считают, что на самом деле это не были батареи, а использовались в основном для религиозных церемоний.
до н.э. в Месопотамии парфянская культура использовала устройство, известное как багдадская батарея, сделанное из медных и железных электродов с уксусом или лимонной кислотой. Археологи считают, что на самом деле это не были батареи, а использовались в основном для религиозных церемоний. Источник изображения: Луиджи Гальвани / Wikimedia Commons.
Источник изображения: Луиджи Гальвани / Wikimedia Commons.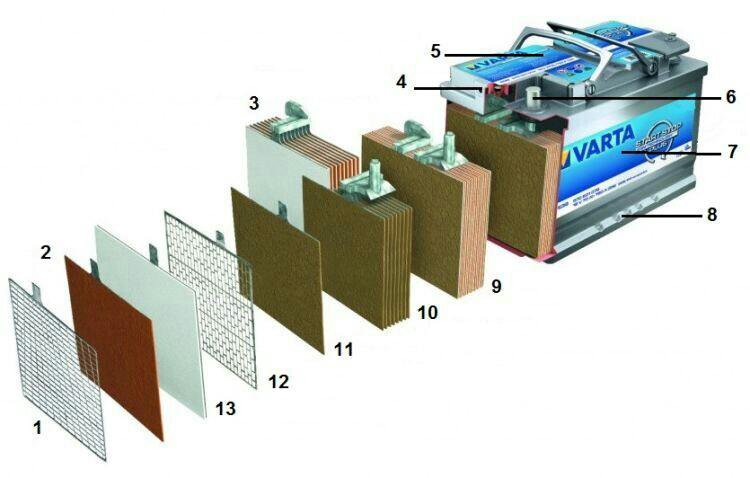 ‘ (мера электрического потенциала) названа в его честь.
‘ (мера электрического потенциала) названа в его честь.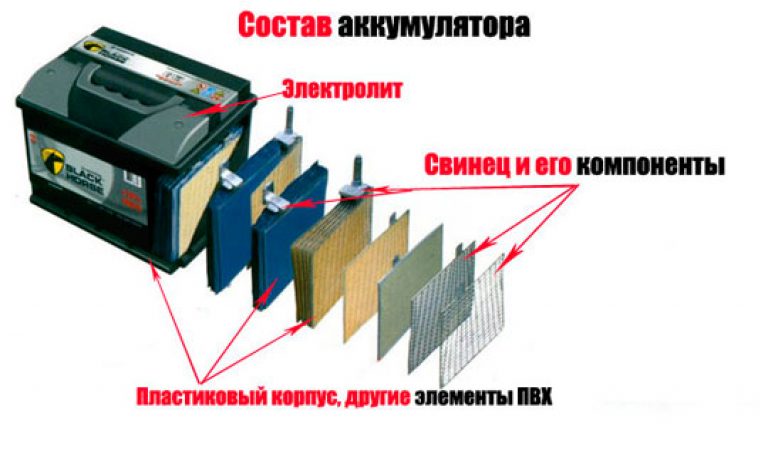 Проще говоря, электричество — это тип энергии, производимый потоком электронов. В электрохимической ячейке электроны образуются в результате химической реакции, которая происходит на одном электроде (подробнее об электродах ниже!), а затем перетекают на другой электрод, где они расходуются. Чтобы понять это правильно, нам нужно поближе взглянуть на компоненты клетки и на то, как они собираются вместе.
Проще говоря, электричество — это тип энергии, производимый потоком электронов. В электрохимической ячейке электроны образуются в результате химической реакции, которая происходит на одном электроде (подробнее об электродах ниже!), а затем перетекают на другой электрод, где они расходуются. Чтобы понять это правильно, нам нужно поближе взглянуть на компоненты клетки и на то, как они собираются вместе.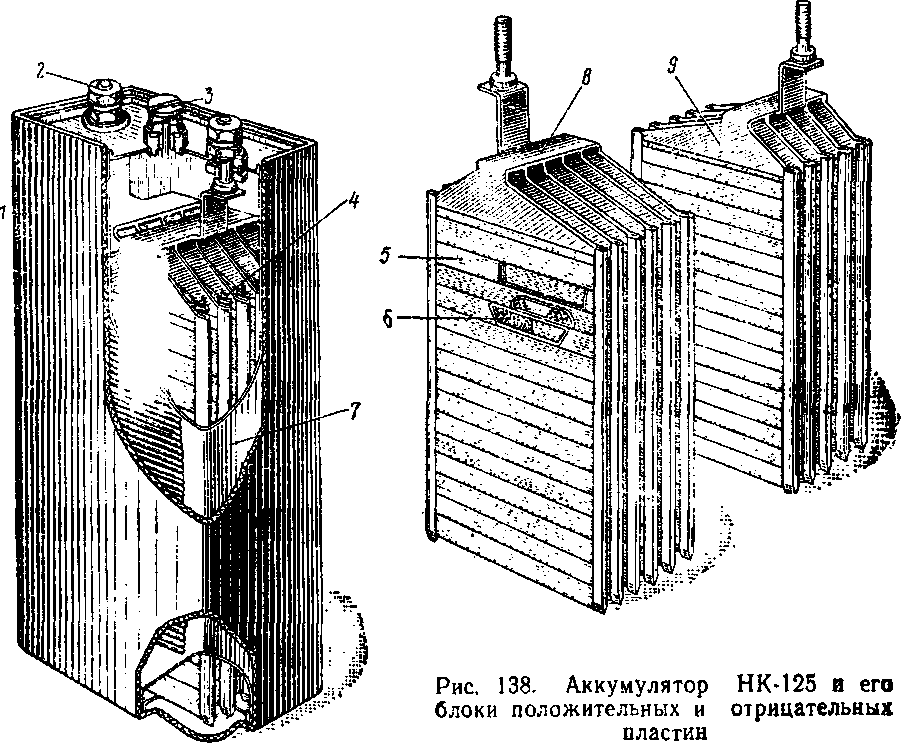
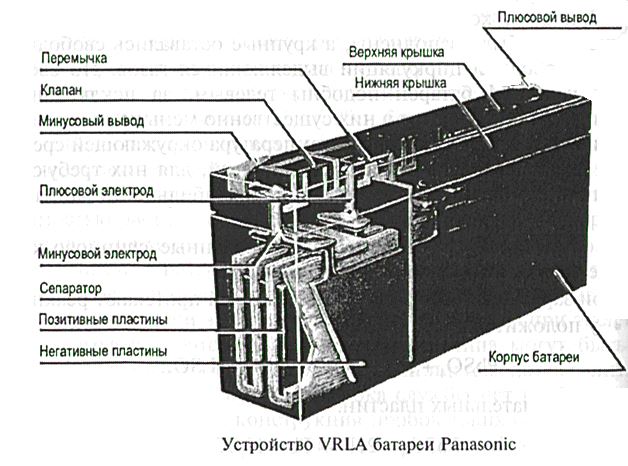
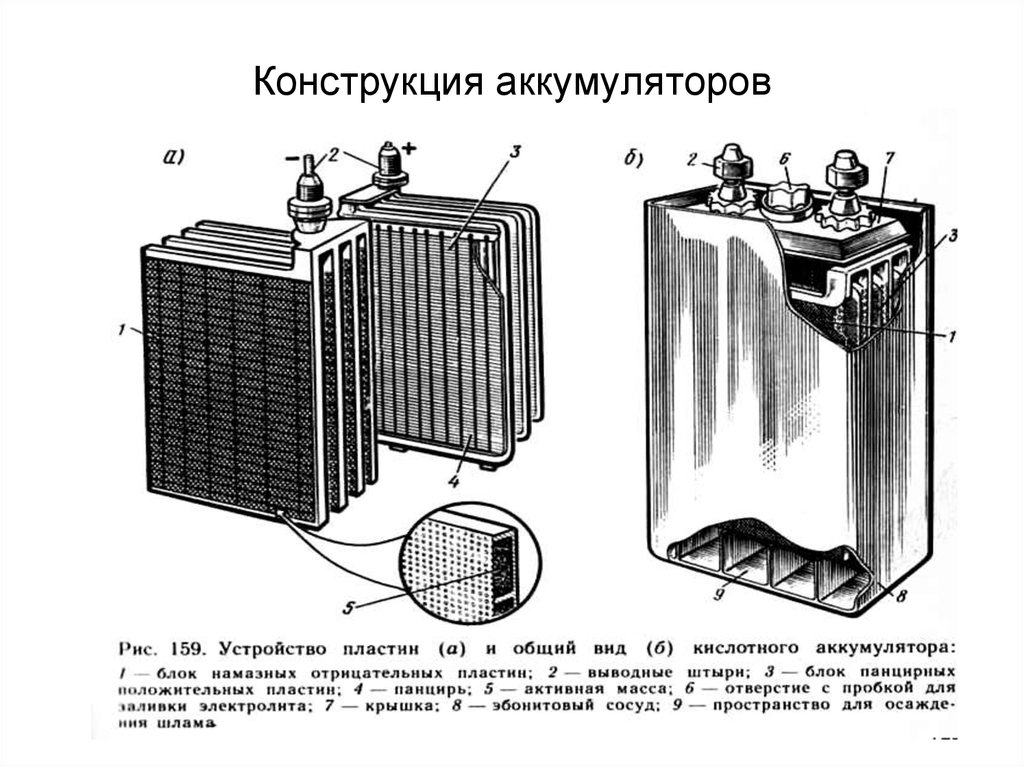 Разница между двумя значениями E 0 говорит вам об электрохимическом потенциале вашей клетки, который в основном представляет собой напряжение ячейки.
Разница между двумя значениями E 0 говорит вам об электрохимическом потенциале вашей клетки, который в основном представляет собой напряжение ячейки.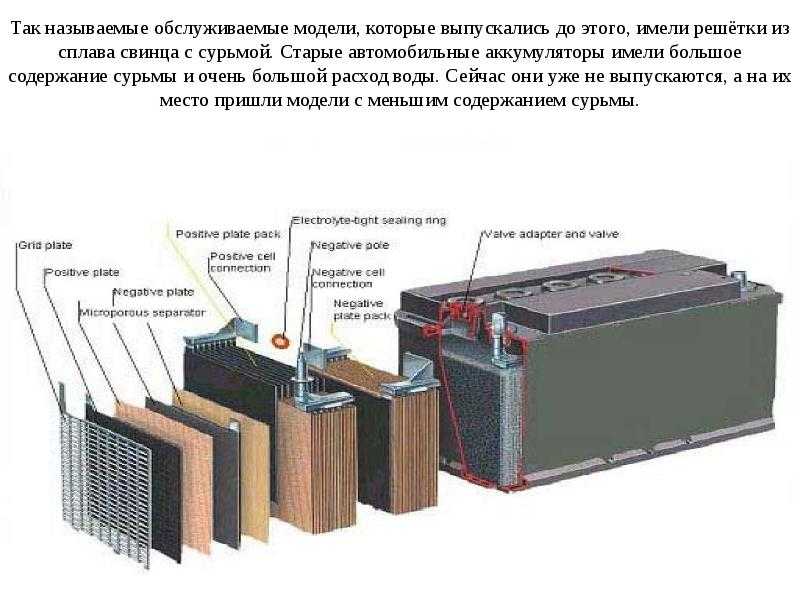 ) + 3e − Al(s)
) + 3e − Al(s) ) + 2e − Sn(s)
) + 2e − Sn(s) ) + 2H 2 O(ж) + 2e − MnO 2 (тв) + 4OH ( − − )
) + 2H 2 O(ж) + 2e − MnO 2 (тв) + 4OH ( − − ) ) + 2H 2 O(л)
) + 2H 2 O(л)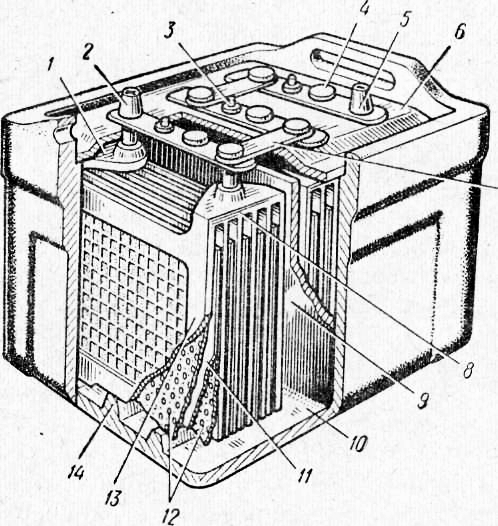 Но идеальным выбором для анода был бы материал, который вызывает реакцию со значительно более низким (более отрицательным) стандартным потенциалом, чем материал, который вы выбрали для своего катода. В итоге мы получаем, что электроны притягиваются к катоду от анода (и анод не пытается сильно сопротивляться), и когда у нас есть легкий путь туда — проводящий провод — мы можем использовать их энергию для обеспечения электрического тока. питание на фонарик, телефон или что-то еще.
Но идеальным выбором для анода был бы материал, который вызывает реакцию со значительно более низким (более отрицательным) стандартным потенциалом, чем материал, который вы выбрали для своего катода. В итоге мы получаем, что электроны притягиваются к катоду от анода (и анод не пытается сильно сопротивляться), и когда у нас есть легкий путь туда — проводящий провод — мы можем использовать их энергию для обеспечения электрического тока. питание на фонарик, телефон или что-то еще. Когда элементы объединены определенным образом (последовательно), это оказывает аддитивное влияние на напряжение батареи. По сути, силу, с которой электроны движутся через батарею, можно рассматривать как общую силу, когда они движутся от анода первой ячейки через все ячейки, содержащиеся в батарее, к катоду последней ячейки.
Когда элементы объединены определенным образом (последовательно), это оказывает аддитивное влияние на напряжение батареи. По сути, силу, с которой электроны движутся через батарею, можно рассматривать как общую силу, когда они движутся от анода первой ячейки через все ячейки, содержащиеся в батарее, к катоду последней ячейки. Электролит обеспечивает среду, через которую могут протекать положительные ионы, уравновешивающие заряд.
Электролит обеспечивает среду, через которую могут протекать положительные ионы, уравновешивающие заряд.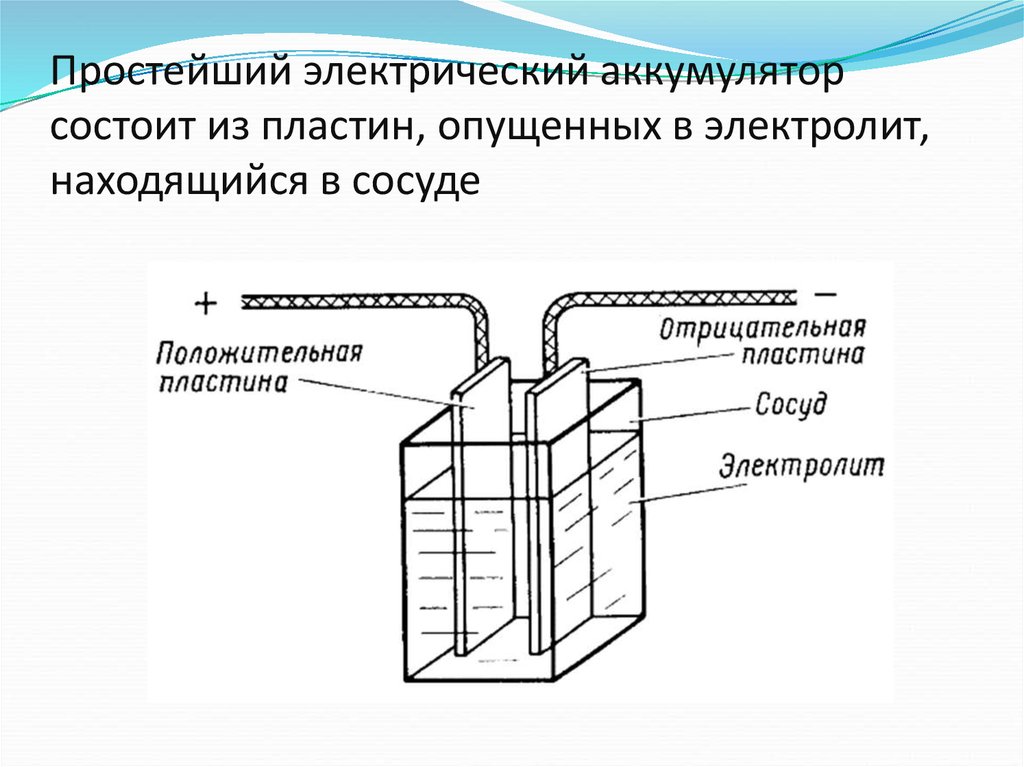 Роль балансировки заряда, которую они выполняют, необходима для поддержания всей реакции.
Роль балансировки заряда, которую они выполняют, необходима для поддержания всей реакции. Когда это сопротивление становится слишком большим, реакция замедляется. Электронное перетягивание каната между катодом и анодом также теряет свою силу, и поток электронов прекращается. Аккумулятор медленно садится.
Когда это сопротивление становится слишком большим, реакция замедляется. Электронное перетягивание каната между катодом и анодом также теряет свою силу, и поток электронов прекращается. Аккумулятор медленно садится.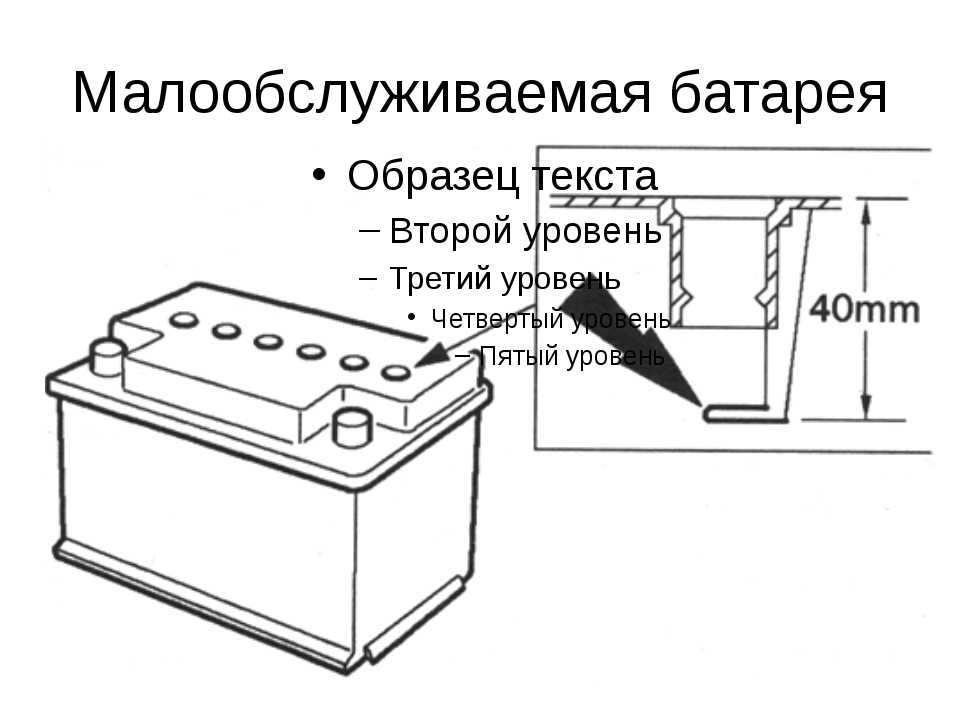 . Точно так же, как батареи изменили то, как мы можем использовать различные электрические устройства, перезаряжаемые батареи еще больше изменили полезность и срок службы этих устройств.
. Точно так же, как батареи изменили то, как мы можем использовать различные электрические устройства, перезаряжаемые батареи еще больше изменили полезность и срок службы этих устройств.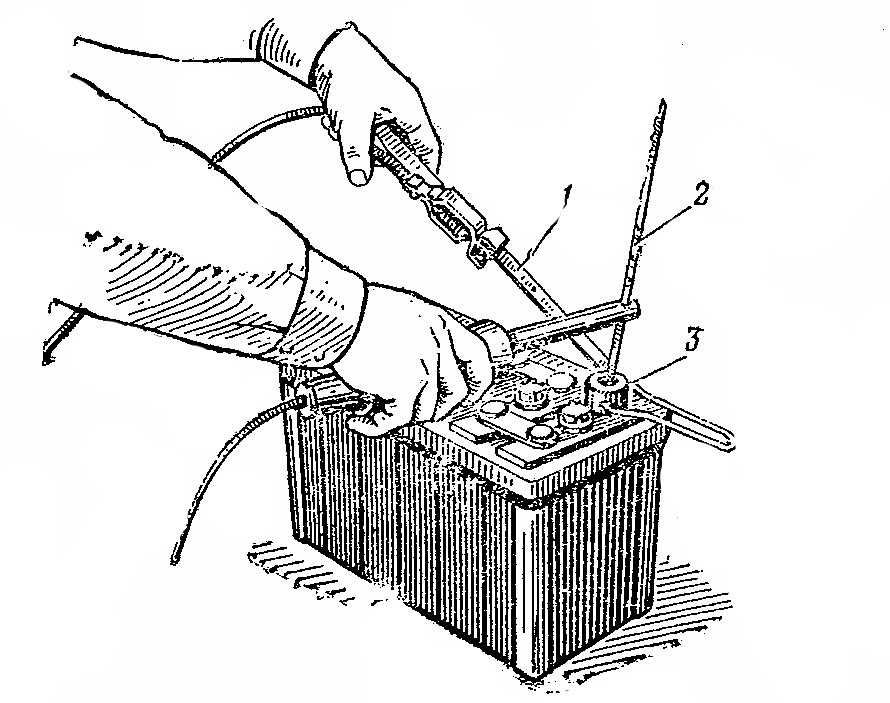 Каждый цикл зарядки ухудшает состояние электродов еще немного, а это означает, что батарея со временем теряет производительность, поэтому даже перезаряжаемые батареи не могут работать вечно.
Каждый цикл зарядки ухудшает состояние электродов еще немного, а это означает, что батарея со временем теряет производительность, поэтому даже перезаряжаемые батареи не могут работать вечно.
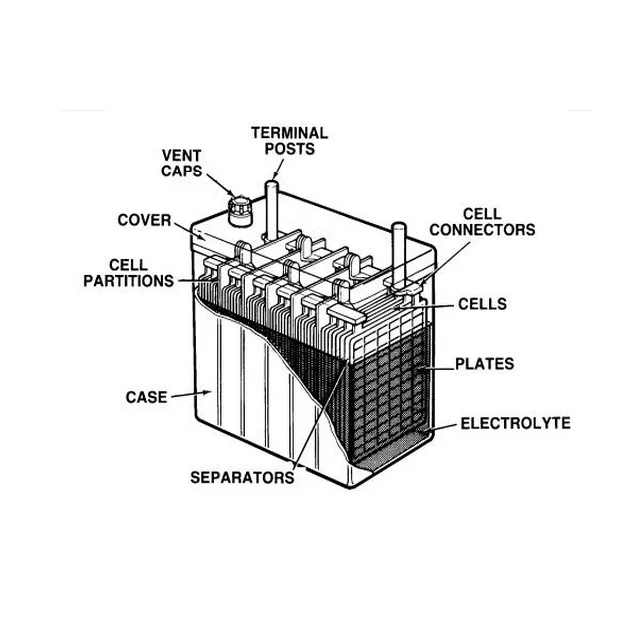


 Для электромобилей это даже плюс — аккумулятор должен как-то влезать в машину!
Для электромобилей это даже плюс — аккумулятор должен как-то влезать в машину!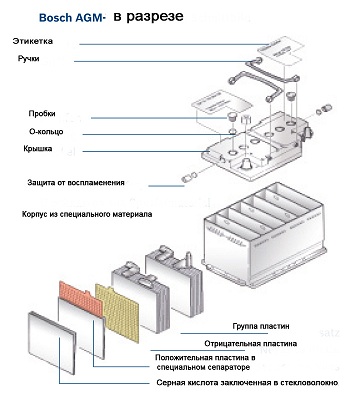 Например, некоторые комбинации будут создавать высокое напряжение очень быстро, но затем быстро падать, не в состоянии поддерживать это напряжение в течение длительного времени. Это хорошо, если вам нужно произвести, скажем, внезапную вспышку света, как вспышка фотокамеры.
Например, некоторые комбинации будут создавать высокое напряжение очень быстро, но затем быстро падать, не в состоянии поддерживать это напряжение в течение длительного времени. Это хорошо, если вам нужно произвести, скажем, внезапную вспышку света, как вспышка фотокамеры.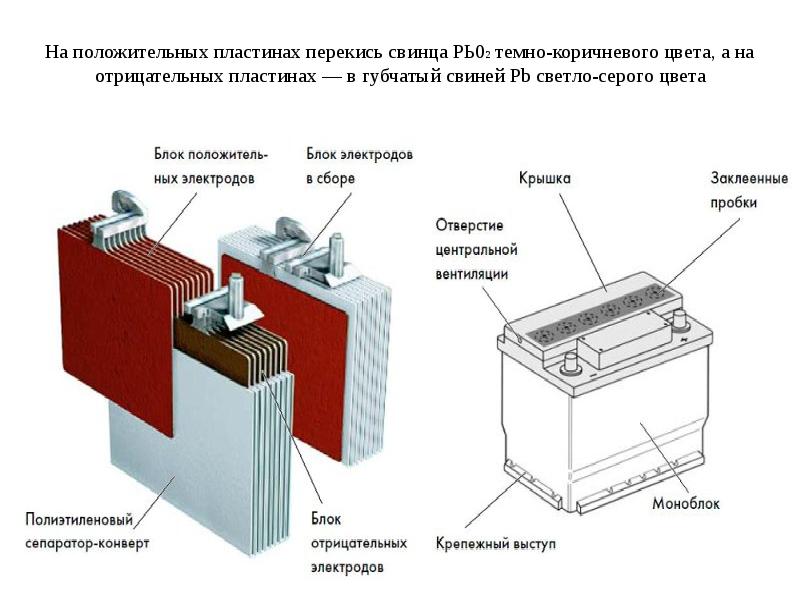 Чтобы узнать больше о них и о том, что ждет аккумулятор в будущем, ознакомьтесь с другими нашими темами Nova.
Чтобы узнать больше о них и о том, что ждет аккумулятор в будущем, ознакомьтесь с другими нашими темами Nova.
 Это преимущество как перед Ni-Cd, так и перед Ni-MH, которые проявляют этот эффект. Литий-ионные аккумуляторы также имеют низкую скорость саморазряда, составляющую около 1,5-2% в месяц. Они не содержат токсичного кадмия, что облегчает их утилизацию по сравнению с Ni-Cd батареями.
Это преимущество как перед Ni-Cd, так и перед Ni-MH, которые проявляют этот эффект. Литий-ионные аккумуляторы также имеют низкую скорость саморазряда, составляющую около 1,5-2% в месяц. Они не содержат токсичного кадмия, что облегчает их утилизацию по сравнению с Ni-Cd батареями.
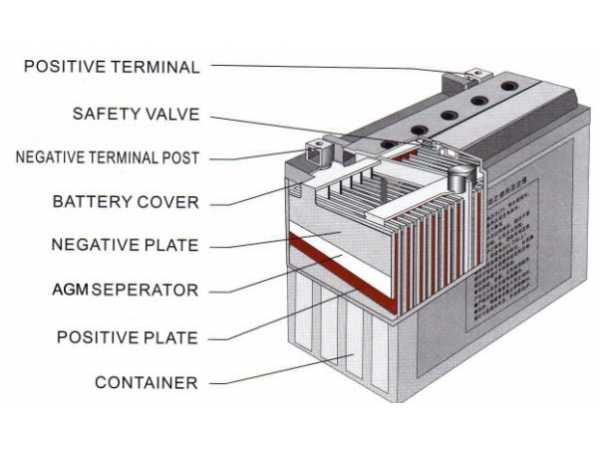 Еще одним фактором, ограничивающим их широкое распространение, является их стоимость, которая примерно на 40% выше, чем у Ni-Cd. Решение этих проблем является ключевым компонентом текущих исследований в области технологии. Наконец, несмотря на высокую плотность энергии литий-ионных аккумуляторов по сравнению с другими типами аккумуляторов, они по-прежнему имеют примерно в сто раз меньшую плотность энергии, чем бензин (который содержит 12 700 Втч/кг по массе или 8760 Втч/л по объему).
Еще одним фактором, ограничивающим их широкое распространение, является их стоимость, которая примерно на 40% выше, чем у Ni-Cd. Решение этих проблем является ключевым компонентом текущих исследований в области технологии. Наконец, несмотря на высокую плотность энергии литий-ионных аккумуляторов по сравнению с другими типами аккумуляторов, они по-прежнему имеют примерно в сто раз меньшую плотность энергии, чем бензин (который содержит 12 700 Втч/кг по массе или 8760 Втч/л по объему). Раньше XANES можно было реализовать только с чрезвычайно высоким потоком излучения от таких инструментов, как синхротрон. Это чрезвычайно большие и дорогие установки стоимостью до 1 миллиарда долларов, которые пользуются таким большим спросом среди ученых, что многомесячные списки ожидания становятся нормой. Используя преимущества новых передовых оптических технологий, лаборатория Зайдлера смогла изготовить небольшой прибор стоимостью 25 000 долларов, который может имитировать измерения, проводимые на синхротроне. С помощью этого нового инструмента ученые могут получать результаты в течение нескольких часов без значительного времени ожидания, что значительно увеличивает скорость разработки нестандартных технологий.
Раньше XANES можно было реализовать только с чрезвычайно высоким потоком излучения от таких инструментов, как синхротрон. Это чрезвычайно большие и дорогие установки стоимостью до 1 миллиарда долларов, которые пользуются таким большим спросом среди ученых, что многомесячные списки ожидания становятся нормой. Используя преимущества новых передовых оптических технологий, лаборатория Зайдлера смогла изготовить небольшой прибор стоимостью 25 000 долларов, который может имитировать измерения, проводимые на синхротроне. С помощью этого нового инструмента ученые могут получать результаты в течение нескольких часов без значительного времени ожидания, что значительно увеличивает скорость разработки нестандартных технологий.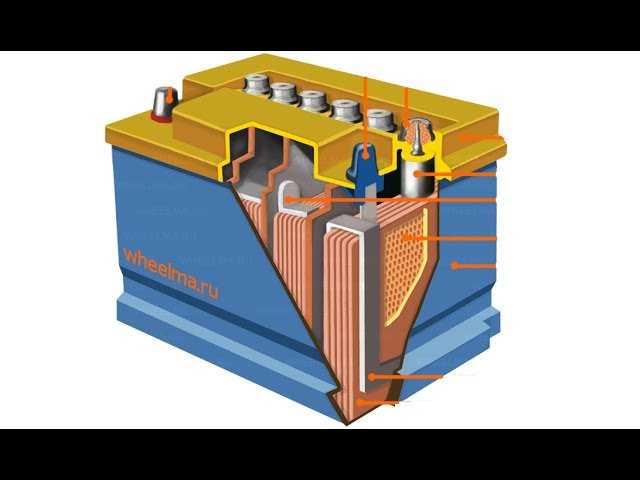 Профессор Венкат Субраманян, руководитель Лаборатории моделирования, анализа и управления технологическими процессами для электрохимических систем (MAPLE), разрабатывает и переформулирует физические модели батарей, а также работает над методами моделирования и решения этих моделей с большей эффективностью и точностью. Создав более эффективную, универсальную и точную модель технологии литий-ионных аккумуляторов, M.A.P.L.E. Исследования лаборатории могут помочь в разработке аккумуляторов более точно для более безопасной и эффективной работы.
Профессор Венкат Субраманян, руководитель Лаборатории моделирования, анализа и управления технологическими процессами для электрохимических систем (MAPLE), разрабатывает и переформулирует физические модели батарей, а также работает над методами моделирования и решения этих моделей с большей эффективностью и точностью. Создав более эффективную, универсальную и точную модель технологии литий-ионных аккумуляторов, M.A.P.L.E. Исследования лаборатории могут помочь в разработке аккумуляторов более точно для более безопасной и эффективной работы. В центре внимания CEI находятся как наука о материалах высокого уровня, такая как разработка и замена альтернативных материалов в литий-ионных батареях, так и характеристика и дизайн наноструктурированных материалов или материалов, свойства которых определяются даже с точностью до нанометра. . Исследователи CEI также изучают материалы, которые могут предложить альтернативу технологиям литий-ионных аккумуляторов.
В центре внимания CEI находятся как наука о материалах высокого уровня, такая как разработка и замена альтернативных материалов в литий-ионных батареях, так и характеристика и дизайн наноструктурированных материалов или материалов, свойства которых определяются даже с точностью до нанометра. . Исследователи CEI также изучают материалы, которые могут предложить альтернативу технологиям литий-ионных аккумуляторов.